题目内容
尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应分为如下两步:
第一步:2NH3(l)+CO2(g)?H2NCOONH4(氨基甲酸铵) (l)△H1=-330.0kJ?mol-1
第二步:H2NCOONH4(l)?H2O(l)+H2NCONH2(尿素)(l)△H2=+226.3kJ?mol-1
(1)写出工业合成尿素的热化学方程式:
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5L密闭容器中投入4mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如图所示:
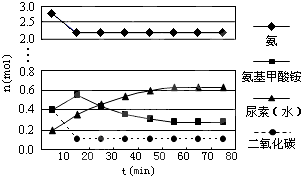
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定.
②反应进行到10min时测得CO2的物质的量为0.26mol,则用CO2表示的第一步反应的速率v(CO2)= .
(3)有一工业投产前的小实验:在一定条件下,向某恒容密闭容器中加入一定量N2和H2的混合气体,达到平衡后,测得混合物中NH3的体积分数为10%,则反应起始时的压强与平衡时的压强之比为 .
第一步:2NH3(l)+CO2(g)?H2NCOONH4(氨基甲酸铵) (l)△H1=-330.0kJ?mol-1
第二步:H2NCOONH4(l)?H2O(l)+H2NCONH2(尿素)(l)△H2=+226.3kJ?mol-1
(1)写出工业合成尿素的热化学方程式:
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5L密闭容器中投入4mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如图所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第
②反应进行到10min时测得CO2的物质的量为0.26mol,则用CO2表示的第一步反应的速率v(CO2)=
(3)有一工业投产前的小实验:在一定条件下,向某恒容密闭容器中加入一定量N2和H2的混合气体,达到平衡后,测得混合物中NH3的体积分数为10%,则反应起始时的压强与平衡时的压强之比为
考点:用盖斯定律进行有关反应热的计算,化学平衡的计算
专题:化学反应中的能量变化,化学平衡专题
分析:(1)根据盖斯定律及已知热化学方程式写出目标热化学方程式;
(2)①已知总反应的快慢由慢的一步决定,结合图象变化趋势,图象表达反应的判断,反应快慢可以依据第一步和第二步反应的曲线斜率比较大小;
②根据图象中二氧化碳在10 min时测得CO2的物质的量计算出用CO2表示的第一步反应的速率v(CO2)
(3)设反应前加入amol N2,bmolH2,达平衡时消耗氮气的物质的量为xmol,根据三段式和氨气的体积分数计算.
(2)①已知总反应的快慢由慢的一步决定,结合图象变化趋势,图象表达反应的判断,反应快慢可以依据第一步和第二步反应的曲线斜率比较大小;
②根据图象中二氧化碳在10 min时测得CO2的物质的量计算出用CO2表示的第一步反应的速率v(CO2)
(3)设反应前加入amol N2,bmolH2,达平衡时消耗氮气的物质的量为xmol,根据三段式和氨气的体积分数计算.
解答:
解:(1)已知①2NH3(l)+CO2(g)═H2NCOONH4(氨基甲酸铵)(l)△H1=-330.0kJ?mol-1
②H2NCOONH4(l)═H2O(l)+H2NCONH2(l)△H2=+226.3kJ?mol-1,
根据盖斯定律,①+②可得:2NH3(l)+CO2(g)═H2O(l)+H2NCONH2 (l),△H=-330.0kJ?mol-1+226.3kJ?mol-1=-103.7kJ?mol-1,
故答案为:2NH3(l)+CO2(g)?H2O(l)+H2NCONH2 (l)△H=-103.7 kJ?mol-1;
(2)①由图象可知在15分钟左右,氨气和二氧化碳反应生成氨基甲酸铵后不再变化发生的是第一步反应,氨基甲酸铵先增大再减小最后达到平衡,发生的是第二部反应,从曲线斜率不难看出第二部反应速率慢,所以已知总反应的快慢由慢的一步决定,
故答案为:二;
②反应进行到10 min时测得CO2的物质的量为0.26mol,二氧化碳的浓度变化为:c(CO2)=
=1.48mol/L,
则用CO2表示的第一步反应的速率v(CO2)=
=0.148 mol/(L?min),
故答案为:0.148 mol/(L?min);
(3)设反应前加入a mol N2,b mol H2,达到平衡时消耗氮气的物质的量为xmol,
N2(g)+3H2(g)?2NH3(g)
起始(mol) a b 0
转化(mol) x 3x 2x
平衡(mol) a-x b-3x 2x
则反应后气体总的物质的量为:(a-x)mol+(b-3x)mol+2xmol=(a+b-2x)mol,
达到平衡时氨气的体积分数为10%,则
×100%=10%,
解得:a+b=22x,
容器容积固定,则压强与物质的量成正比,
故起始时压强与平衡时压强之比为:
=
=11:10,
故答案为:11:10.
②H2NCOONH4(l)═H2O(l)+H2NCONH2(l)△H2=+226.3kJ?mol-1,
根据盖斯定律,①+②可得:2NH3(l)+CO2(g)═H2O(l)+H2NCONH2 (l),△H=-330.0kJ?mol-1+226.3kJ?mol-1=-103.7kJ?mol-1,
故答案为:2NH3(l)+CO2(g)?H2O(l)+H2NCONH2 (l)△H=-103.7 kJ?mol-1;
(2)①由图象可知在15分钟左右,氨气和二氧化碳反应生成氨基甲酸铵后不再变化发生的是第一步反应,氨基甲酸铵先增大再减小最后达到平衡,发生的是第二部反应,从曲线斜率不难看出第二部反应速率慢,所以已知总反应的快慢由慢的一步决定,
故答案为:二;
②反应进行到10 min时测得CO2的物质的量为0.26mol,二氧化碳的浓度变化为:c(CO2)=
| 1mol-0.26mol |
| 0.5L |
则用CO2表示的第一步反应的速率v(CO2)=
| 0.148mol/L |
| 10min |
故答案为:0.148 mol/(L?min);
(3)设反应前加入a mol N2,b mol H2,达到平衡时消耗氮气的物质的量为xmol,
N2(g)+3H2(g)?2NH3(g)
起始(mol) a b 0
转化(mol) x 3x 2x
平衡(mol) a-x b-3x 2x
则反应后气体总的物质的量为:(a-x)mol+(b-3x)mol+2xmol=(a+b-2x)mol,
达到平衡时氨气的体积分数为10%,则
| 2x |
| a+b-2x |
解得:a+b=22x,
容器容积固定,则压强与物质的量成正比,
故起始时压强与平衡时压强之比为:
| a+b |
| a+b-2x |
| 22x |
| 22x-2x |
故答案为:11:10.
点评:本题考查了热化学方程式的书写、化学平衡的计算,题目难度中等,注意掌握盖斯定律的内容及应用方法,能够利用三段式进行化学平衡的计算,明确反应速率的概念及计算方法,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
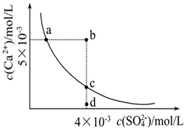 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列说
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列说法正确的是( )
| A、常温下,向100mL CaSO4饱和溶液中,加入400mL 0.01mol/LNa2SO4溶液后,溶液中无沉淀析出 |
| B、b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol/L |
| C、d点溶液通过蒸发可以变到c点 |
| D、a点对应的Ksp等于c点对应的Ksp |
下列叙述正确的是( )
| A、向AgCl悬浊液中加入足量的NaI溶液,无明显现象 |
| B、CCl4和NH3两分子各原子最外层均满足8电子结构 |
| C、若短周期R2+和M+的电子层结构相同,则金属性R>M |
| D、硝酸铵溶于水吸热,是焓减熵增的过程 |
实验室中利用复分解反应制取Mg(OH)2.实验数据和现象如下表所示(溶液体积均取用1mL)
关于以上实验的说法正确是( )
| 组别 | 药品1 | 药品2 | 实验现象 |
| Ⅰ | 0.1mol/LNaOH溶液 | 0.1mol/LMgCl2溶液 | 生成白色沉淀 |
| Ⅱ | 0.1mol/L氨水 | 0.1mol/LMgCl2溶液 | 无现象 |
| Ⅲ | 1mol/L氨水 | 1mol/LMgCl2溶液 | 现象Ⅲ |
| Ⅳ | 1mol/L氨水 | 0.1mol/LMgCl2溶液 | 生成白色沉淀 |
| Ⅴ | 0.1mol/L氨水 | 1mol/LMgCl2溶液 | 无现象 |
| A、实验Ⅱ、Ⅴ无现象,而Ⅳ生成白色沉淀,说明增大c(Mg2+)不能向生成沉淀的方向移动,增大氨水溶液的浓度才能向生成沉淀的方向移动 |
| B、实验Ⅲ无现象,因为氯化镁溶液和氨水浓度都增大,则导致氯化铵浓度增大,而氢氧化镁可以溶解在氯化铵溶液中 |
| C、由于氢氧化镁可以溶解在氯化铵溶液中,而氯化镁溶液和氨水反应可以生成氯化铵,所以该两种溶液混合后可能会出现先生成沉淀后溶解的现象 |
| D、实验Ⅲ的现象是生成白色沉淀,因为增大两种溶液中任意一种的浓度,都能使混合液的离子积达到氢氧化镁的Ksp |
已知2SO2(g)+O2(g)?2SO3(g)△H=-196.6KJ/mol,下列说法正确的是( )
| A、1molSO2(g)和0.5molO2(g)置于密闭容器中 在一定条件下充分反应,放热98.3KJ |
| B、若升高温度,正反应速率增大,逆反应速率减小 |
| C、其他条件不变时,加入催化剂,速率一定加快 |
| D、2molSO2(g)和1molO2(g)具有的能量之和大于2molSO3(g)具有的能量 |
有关AgCl沉淀的溶解平衡说法正确的是( )
| A、AgCl沉淀生成和溶解不断进行,但速率相等 |
| B、AgCl难溶于水,其溶液中没有Ag+和Clˉ |
| C、升高温度,AgCl沉淀的溶解度不变 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变 |