题目内容
12.下列关于电解质的判断中,正确的观点是( )| A. | 在熔融状态下能导电的物质 | |
| B. | 在熔融或溶解状态下能导电的物质 | |
| C. | 在溶解或熔融状态下能导电的化合物 | |
| D. | 在熔融和溶液的状态下都能导电的化合物 |
分析 在水溶液中或溶质状态下能导电的化合物为电解质,在水溶液中和熔融状态下均不能导电的化合物为非电解质,据此分析.
解答 解:水溶液中或溶质状态下能导电的化合物为电解质,即电解质必须是化合物,且将此化合物溶于水后或加热到熔融状态下能导电,故选C.
点评 本题考查了对电解质概念的理解,难度不大,应注意的是电解质概念判断的要点.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
2.下列分子的价电子模型(VSEPR模型)和分子的模型相同的是( )
| A. | CO2 | B. | NH3 | C. | H2O | D. | SO2 |
3.在用Zn片、Cu片和稀硫酸组成的电池装置中,下列说法中正确的是( )
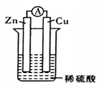

| A. | 溶液中的阳离子向正极移动,阴离子向负极移动 | |
| B. | 经过一段时问工作后'电解液的pH值减小 | |
| C. | 锌片是正极,铜片上有气泡产生 | |
| D. | 电流方向是从锌片流向铜片 |
20.对于化学反应能否自发进行,下列说法中错误的是( )
| A. | 若△H<0,△S>0,任何温度下都能自发进行 | |
| B. | 若△H>0,△S<0,任何温度下都不能自发进行 | |
| C. | 需要加热才能够进行的过程肯定不是自发过程 | |
| D. | 非自发过程在一定条件下可能变成自发过程 |
17.常温下,与100mL0.10mol/LMgCl2溶液中Cl-浓度相等的是( )
| A. | 200mL0.1mol/LKCl溶液 | B. | 200mL0.10mol/LNaCl溶液 | ||
| C. | 200 mL 0.10mol/LBaCl2溶液 | D. | 100mL0.1mol/LAl2(SO4)3溶液 |
4.某元素基态原子电子排布式为[Ar]3d104s2,它在元素周期表中的位置是( )
| A. | 第3周期ⅡB族 | B. | 第4周期ⅡB族 | C. | 第4周期ⅦB族 | D. | 第4周期Ⅷ族 |
10.在一定条件下,发生反应:aA(g)+bB(g)?cC(g)△H=“Q“kJ/mol,其化学平衡常数K和温度的关系如表所示:
(1)依据图表判断该反应△H< 0(填“>”或“<”).
(2)500℃,固定容器的密闭容器中,放入混合物,其始浓度为c(A)=0.25mol/L,c(B)=0.60mol/L,c(C)=0.30mol/L,则反应开始时,B的消耗速率比生成速率不能确定 (填“大”、“小”或“不能确定”).
| t℃ | 400 | 500 | 800 | 1000 |
| K | 2.6 | 1.6 | 1.0 | 0.40 |
(2)500℃,固定容器的密闭容器中,放入混合物,其始浓度为c(A)=0.25mol/L,c(B)=0.60mol/L,c(C)=0.30mol/L,则反应开始时,B的消耗速率比生成速率不能确定 (填“大”、“小”或“不能确定”).