题目内容
14.下列各组离子一定能大量共存的是( )| A. | 在无色溶液中:NH4+、Fe2+、SO42-、CO32- | |
| B. | 在含大量Ba2+溶液中:NH4+、Na+、Cl-、CO32- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、SO32- | |
| D. | 在酸性的溶液中:K+、Fe2+、Cl-、CH3COO- |
分析 A.Fe2+为浅绿色;
B.离子之间结合生成沉淀;
C.强碱溶液中该组离子之间不反应;
D.酸性溶液中不能大量存在弱酸根离子.
解答 解:A.Fe2+为浅绿色,与无色不符,且Fe2+、CO32-结合生成沉淀,不能共存,故A不选;
B.Ba2+、CO32-结合生成沉淀,不能共存,故B不选;
C.强碱溶液中该组离子之间不反应,可大量共存,故C选;
D.酸性溶液中不能大量存在CH3COO-,故D不选;
故选C.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答关键,侧重分析与应用能力的考查,注意复分解反应反应的判断,题目难度不大.

练习册系列答案
相关题目
4.下列说法正确的是( )
| A. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| B. | 活化分子间的碰撞一定能导致化学键断裂 | |
| C. | 在FeCl3+3KSCN═Fe(SCN)3+3KCl平衡体系中,加入KCl固体,平衡逆向移动 | |
| D. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol,能自发进行,原因是体系有自发地向熵增的方向转变的倾向 |
5.误服重金属盐使人中毒,应及时采用哪种措施救助?( )
| A. | 喝大量冷开水 | B. | 喝大量食盐水 | ||
| C. | 喝大量牛奶 | D. | 注射大量葡萄糖水 |
2.下列分子的价电子模型(VSEPR模型)和分子的模型相同的是( )
| A. | CO2 | B. | NH3 | C. | H2O | D. | SO2 |
9.在Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2的中,下列叙述正确的是( )
| A. | Fe2O3 是还原剂 | B. | CO是氧化剂 | ||
| C. | 氧化剂得到6mol电子 | D. | 还原剂失去8mol电子 |
6.在2A+B?3C+4D中,表示该反应速率最快的是( )
| A. | υ(A)=0.5mol•L-1•S-1 | B. | υ(B)=0.3 mol•L-1•S-1 | ||
| C. | υ(C)=0.8mol•L-1•S-1 | D. | υ(D)=1 mol•L-1•S-1 |
3.在用Zn片、Cu片和稀硫酸组成的电池装置中,下列说法中正确的是( )
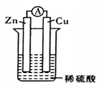

| A. | 溶液中的阳离子向正极移动,阴离子向负极移动 | |
| B. | 经过一段时问工作后'电解液的pH值减小 | |
| C. | 锌片是正极,铜片上有气泡产生 | |
| D. | 电流方向是从锌片流向铜片 |
4.某元素基态原子电子排布式为[Ar]3d104s2,它在元素周期表中的位置是( )
| A. | 第3周期ⅡB族 | B. | 第4周期ⅡB族 | C. | 第4周期ⅦB族 | D. | 第4周期Ⅷ族 |
