题目内容
氨的合成是重要的一项化工生产.已知合成氨有关能量变化的图象如图1.
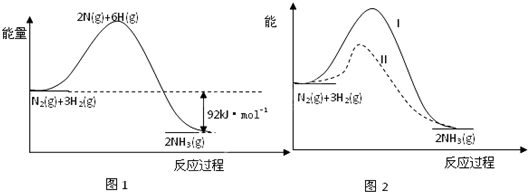
(1)反应 N2(g)+3H2(g)?2NH3(g)△H= ;
(2)化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.现提供以下化学键的键能(kJ?mol-1):H-H:436,N≡N:946,则N-H的键能是 kJ?mol-1;
(3)在一定条件下按图2实线I进行,改变某条件按图2虚线II进行,则该条件可能是 ;
(4)在一个密闭容器中加入1molN2、3mol H2,一定条件下充分反应,其热效应始终小于92kJ,请说明原因 ;
(5)在一个密闭容器中加入amolN2、bmol H2,达到平衡时n(N2):n(H2)=1:3,则a:b= .

(1)反应 N2(g)+3H2(g)?2NH3(g)△H=
(2)化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.现提供以下化学键的键能(kJ?mol-1):H-H:436,N≡N:946,则N-H的键能是
(3)在一定条件下按图2实线I进行,改变某条件按图2虚线II进行,则该条件可能是
(4)在一个密闭容器中加入1molN2、3mol H2,一定条件下充分反应,其热效应始终小于92kJ,请说明原因
(5)在一个密闭容器中加入amolN2、bmol H2,达到平衡时n(N2):n(H2)=1:3,则a:b=
考点:反应热和焓变,有关反应热的计算,化学反应的可逆性
专题:化学反应中的能量变化,化学平衡专题
分析:(1)从图象可知,反应物能量高于生成物,反应放热,△H=生成物能量和-反应物能量和;
(2)据△H=反应物键能和-生成物键能和求算;
(3)反应的活化能降低了,催化剂能够降低反应的活化能;
(4)焓变是生成物与反应物能量差,可逆反应不能完全转化,放热比焓变小;
(5)合成氨反应中氮气和氢气的物质的量之比为1:3,平衡时为1:3,说明加入的反应物之比一定为1:3.
(2)据△H=反应物键能和-生成物键能和求算;
(3)反应的活化能降低了,催化剂能够降低反应的活化能;
(4)焓变是生成物与反应物能量差,可逆反应不能完全转化,放热比焓变小;
(5)合成氨反应中氮气和氢气的物质的量之比为1:3,平衡时为1:3,说明加入的反应物之比一定为1:3.
解答:
解:(1)从图象可知,△H=生成物能量和-反应物能量和=-92KJ/mol,故答案为:-92KJ/mol;
(2)△H=反应物键能和-生成物键能和,-92KJ/mol=3×436KJ/mol+946KJ/mol-6×Q(N-H),所以Q(N-H)=360.3KJ/mol,故答案为:360.3;
(3)实线I比虚线II的活化能高,其他相同,说明使用了催化剂,因为催化剂是通过降低反应的活化能加快反应速率的,故答案为:加入催化剂;
(4)可逆反应的反应物不能完全转化,放热就少,故答案为:可逆反应不能完全转化;
(5)合成氨反应中氮气和氢气的物质的量之比为1:3,平衡时为1:3,说明加入的反应物之比一定为1:3,所以a:b=1:3,故答案为:1:3.
(2)△H=反应物键能和-生成物键能和,-92KJ/mol=3×436KJ/mol+946KJ/mol-6×Q(N-H),所以Q(N-H)=360.3KJ/mol,故答案为:360.3;
(3)实线I比虚线II的活化能高,其他相同,说明使用了催化剂,因为催化剂是通过降低反应的活化能加快反应速率的,故答案为:加入催化剂;
(4)可逆反应的反应物不能完全转化,放热就少,故答案为:可逆反应不能完全转化;
(5)合成氨反应中氮气和氢气的物质的量之比为1:3,平衡时为1:3,说明加入的反应物之比一定为1:3,所以a:b=1:3,故答案为:1:3.
点评:本题考查了焓变的两种求算方法、催化剂对反应的影响、可逆反应的反应热、速率正比等于化学计量数之比,题目难度不大.

练习册系列答案
相关题目
下列有机物命名正确的是( )
A、1,3,4-三甲苯 |
B、α-氨基苯丙酸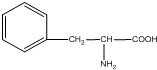 |
| C、2-甲基丙烯 (CH3)2C=CH2 |
| D、2,2-二甲基-3-丁醇 (CH3)3C-CHOH-CH3 |
在pH=3的FeCl3溶液和pH=3的盐酸中,由水电离出来的H+的浓度分别为C1、C2,pH=11的Na2CO3溶液中水电离出来的OH-的浓度为C3,则它们之间的关系是( )
| A、C1<C2<C3 |
| B、C1=C3>C2 |
| C、C1>C2>C3 |
| D、无法判断 |

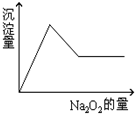 有一透明溶液,可能含有Al3+、Fe3+、K+、Mg2+和Cu2+等离子中的一种或几种.现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀.如加入Na2O2的量与生成白色沉淀的量之间的关系用图来表示.
有一透明溶液,可能含有Al3+、Fe3+、K+、Mg2+和Cu2+等离子中的一种或几种.现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀.如加入Na2O2的量与生成白色沉淀的量之间的关系用图来表示.