题目内容
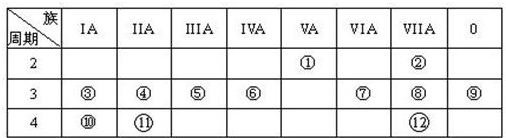
图1为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
(1)④、⑤、⑦的原子半径由大到小的顺序为 (用元素符号表示,下同).
(2)⑥和⑦的最高价含氧酸的酸性强弱为 .
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化写出该反应的离子方程式
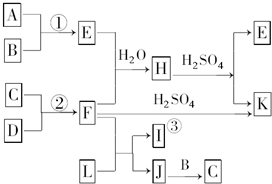
(4)由表中元素形成的物质可发生如图2中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性.
①写出D溶液与G反应的化学方程式
②常温下,若电解1L0.1mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化)则该电解过程中转移电子的物质的量为 mol.

(1)④、⑤、⑦的原子半径由大到小的顺序为
(2)⑥和⑦的最高价含氧酸的酸性强弱为
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化写出该反应的离子方程式
(4)由表中元素形成的物质可发生如图2中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性.
①写出D溶液与G反应的化学方程式
②常温下,若电解1L0.1mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化)则该电解过程中转移电子的物质的量为
考点:元素周期律和元素周期表的综合应用,无机物的推断
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知①为H、②为O、③为Al、④为F、⑤为Na、⑥为S、⑦为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)非金属性越强,最高价含氧酸的酸性越强;
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物为H2O2,在酸性溶液中能将Fe2+氧化Fe3+,同时生成水;
(4)由表中元素形成的物质,其中B、C、G是单质,B为黄绿色气体,则B为Cl2,D溶液显碱性,电解A溶液为电解氯化钠溶液生成氢气、氯气与氢氧化钠,故D为NaOH、C为H2、E为HCl,G能与氢氧化钠溶液反应得到得到氢气,故G为Al,F为NaAlO2,据此解答.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)非金属性越强,最高价含氧酸的酸性越强;
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物为H2O2,在酸性溶液中能将Fe2+氧化Fe3+,同时生成水;
(4)由表中元素形成的物质,其中B、C、G是单质,B为黄绿色气体,则B为Cl2,D溶液显碱性,电解A溶液为电解氯化钠溶液生成氢气、氯气与氢氧化钠,故D为NaOH、C为H2、E为HCl,G能与氢氧化钠溶液反应得到得到氢气,故G为Al,F为NaAlO2,据此解答.
解答:
解:由元素在周期表中位置,可知①为H、②为O、③为Al、④为F、⑤为Na、⑥为S、⑦为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Cl>F,故答案为:Na>Cl>F;
(2)非金属性Cl>S,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H2SO4,故答案为:HClO4>H2SO4;
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物为H2O2,在酸性溶液中能将Fe2+氧化Fe3+,同时生成水,
反应离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)由表中元素形成的物质,其中B、C、G是单质,B为黄绿色气体,则B为Cl2,D溶液显碱性,电解A溶液为电解氯化钠溶液生成氢气、氯气与氢氧化钠,故D为NaOH、C为H2、E为HCl,G能与氢氧化钠溶液反应得到得到氢气,故G为Al,F为NaAlO2,
①D溶液与G反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
②常温下,若电解1L 0.1mol/L的NaCl溶液,一段时间后测得溶液pH为12,则溶液中的c(OH -)=10-2mol/L,则n(NaOH)=0.01mol/L×1L=0.01mol,由2NaCl+2H2O
2NaOH+H2↑+Cl2↑,可知生成氯气为0.01mol×
=0.005mol,故转移电子物质的量=0.005mol×2=0.01mol,故答案为:0.01.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Cl>F,故答案为:Na>Cl>F;
(2)非金属性Cl>S,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H2SO4,故答案为:HClO4>H2SO4;
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物为H2O2,在酸性溶液中能将Fe2+氧化Fe3+,同时生成水,
反应离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)由表中元素形成的物质,其中B、C、G是单质,B为黄绿色气体,则B为Cl2,D溶液显碱性,电解A溶液为电解氯化钠溶液生成氢气、氯气与氢氧化钠,故D为NaOH、C为H2、E为HCl,G能与氢氧化钠溶液反应得到得到氢气,故G为Al,F为NaAlO2,
①D溶液与G反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
②常温下,若电解1L 0.1mol/L的NaCl溶液,一段时间后测得溶液pH为12,则溶液中的c(OH -)=10-2mol/L,则n(NaOH)=0.01mol/L×1L=0.01mol,由2NaCl+2H2O
| ||
| 1 |
| 2 |
点评:本题考查元素周期表与元素周期律、无机物推断等,题目难度中等,(4)中关键是根据离子放电顺序理解电解原理,进而判断A物质.

练习册系列答案
相关题目