题目内容
4.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:C2H6+7O2+8KOH=4K2CO3+10H2O,有关此电池的推断正确的是( )| A. | 负极反应为:14H2O+7O2+28e-=28OH- | |
| B. | 放电一段时间后,负极周围的pH升高 | |
| C. | 放电过程中OH-向正极移动 | |
| D. | 每消耗1mol C2H6,则电路上转移的电子为14mol |
分析 由电池总反应2C2H6+7O2+8KOH=4K2CO3+10H2O可知,原电池工作时C2H6被氧化生成K2CO3,应为原电池的负极,电极反应式为C2H6+18OH--14e-=2CO32-+12H2O,O2得电子被还原,应为原电池正极,电极反应式为2H2O+O2+4e-=4OH-,结合电极反应式解答该题.
解答 解:A.负极发生氧化反应,应为C2H6+18OH--14e-=2CO32-+12H2O,故A错误;
B.由负极电极方程式可知,负极消耗OH-离子,负极周围的pH值减小,故B错误;
C.电池工作过程中,放电过程中OH-向负极移动,故C错误;
D.负极电极反应式为C2H6+18OH--14e-=2CO32-+12H2O,由电极方程式可知每消耗1molC2H6,则电路上转移的电子为14mol,故D正确;
故选D.
点评 本题考查原电池知识,题目难度中等,注意电极反应式的书写和电解质溶液的酸碱性变化,正确书写电极方程式为解答该题的关键,做题时注意体会.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
12.下列各离子组能在强酸性溶液中大量共存的是( )
| A. | K+、Cl-、Fe3+、CO32- | B. | H+、Cl-、ClO-、Ca2+ | ||
| C. | Mg2+、Cl-、NO3-、K+ | D. | K+、ClO-、NO3-、Fe2+ |
19.可逆反应mA(s)+nB(g)?cC(g)+dD(g) 反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )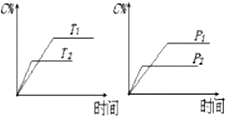

| A. | 达平衡后,加入催化剂则C%增大 | B. | 达平衡后,若升温,平衡左移 | ||
| C. | 化学方程式中n>c+d | D. | 达平衡后,增加A的量平衡向右移动 |
9.原子序数为Z的主族元素R,在周期表中位于A、B、C、D四种主族元素的中间,A、B、C、D四种元素的原子序数之和为下列数据,其中不可能的是( )
| C | ||
| A | R | B |
| D |
| A. | 4 Z | B. | 4 Z+10 | C. | 4 Z+5 | D. | 4 Z+14 |
13.25℃时,向盛有50mL pH=3的HA溶液的绝热容器中加入pH=14的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述正确的是( )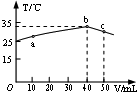

| A. | HA溶液的物质的量浓度为0.01mol/L | |
| B. | a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+) | |
| C. | b→c的过程中,温度降低的主要原因是溶液中A-发生了水解反应 | |
| D. | 25℃时,HA的电离平衡常数K约为1.25×10-3 |
10.向100mL0.4mol/L的氢氧化钡溶液中加入足量稀硫酸充分反应后,放出5.12kJ的热量.如果向100mL0.4mol/L的稀盐酸中加入足量氢氧化钡溶液充分反应后,放出2.2kJ的热量.则硫酸钠溶液与氯化钡溶液反应的热化学方程式( )
| A. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-2.92kJ/mol | |
| B. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-0.72kJ/mol | |
| C. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-18kJ/mol | |
| D. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-73kJ/mol |
 .
.