题目内容
10.向100mL0.4mol/L的氢氧化钡溶液中加入足量稀硫酸充分反应后,放出5.12kJ的热量.如果向100mL0.4mol/L的稀盐酸中加入足量氢氧化钡溶液充分反应后,放出2.2kJ的热量.则硫酸钠溶液与氯化钡溶液反应的热化学方程式( )| A. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-2.92kJ/mol | |
| B. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-0.72kJ/mol | |
| C. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-18kJ/mol | |
| D. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-73kJ/mol |
分析 向H2SO4溶液中加入100mL 0.4mol•L-1 Ba(OH)2溶液反应涉及的离子方程式有Ba2+(aq)+SO42-(aq)=BaSO4(s),H+(aq)+OH-(aq)=H20(l),向足量Ba(OH)2溶液中加入100mL 0.4mol•L-1 HCl溶液时,反应涉及的离子方程式为H+(aq)+OH-(aq)=H20(l),Na2SO4溶液与BaCl2溶液反应的离子方程式为Ba2+(aq)+SO42-(aq)=BaSO4(s),从能量守恒的角度解答.
解答 解:100mL 0.4mol•L-1 Ba(OH)2的物质的量为0.04mol,向H2SO4溶液中加入100mL 0.4mol•L-1 Ba(OH)2溶液反应涉及的离子方程式有Ba2+(aq)+SO42-(aq)=BaSO4(s),H+(aq)+OH-(aq)=H20(l),100mL 0.4mol•L-1 HCl的物质的量为0.04mol,反应涉及的离子方程式为H+(aq)+OH-(aq)=H20(l),根据放出的热量为2.2kJ,
可知H+(aq)+OH-(aq)=H20(l)△H=-$\frac{2.2kJ}{0.04mol}$=-55kJ•mol-1,
设Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-QkJ•mol-1,
则0.04Q+0.08mol×55kJ•mol-1=5.12kJ,解之得Q=18,
所以Na2SO4溶液与BaCl2溶液反应的热化学方程式为Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-18kJ•mol-1.
故选C.
点评 本题考查热化学方程式的书写和反应热的计算,题目难度不大,注意从能量守恒的角度解答该题.

练习册系列答案
相关题目
4.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:C2H6+7O2+8KOH=4K2CO3+10H2O,有关此电池的推断正确的是( )
| A. | 负极反应为:14H2O+7O2+28e-=28OH- | |
| B. | 放电一段时间后,负极周围的pH升高 | |
| C. | 放电过程中OH-向正极移动 | |
| D. | 每消耗1mol C2H6,则电路上转移的电子为14mol |
1.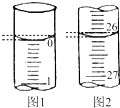 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:
(1)滴定时一般左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶,直到加入最后一滴盐酸,溶液溶液颜色由红色变为无色,且半分钟内不变色,即达到滴定终点.若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸的体积为26.10 mL.
(2)某学生重复三次实验,记录数据如下表所示(待测NaOH溶液的体积均为25.00mL);
计算所测氢氧化钠溶液的物质的量浓度为0.1044 mol/L(保留四位小数)
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏高的是AC.
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴处在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定开始时仰视读数,滴定结束时俯视读数.
 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:(1)滴定时一般左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶,直到加入最后一滴盐酸,溶液溶液颜色由红色变为无色,且半分钟内不变色,即达到滴定终点.若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸的体积为26.10 mL.
(2)某学生重复三次实验,记录数据如下表所示(待测NaOH溶液的体积均为25.00mL);
| 滴定次数 | 0.1000mol-L-1盐酸的体积/mL | ||
| 滴定前 | 滴定后 | 体积/mL | |
| 1 | 0.10 | 26.21 | 26.11 |
| 2 | 1.56 | 31.30 | 29.74 |
| 3 | 0.22 | 26.31 | 26.09 |
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏高的是AC.
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴处在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定开始时仰视读数,滴定结束时俯视读数.
18.某厂用Na 除掉苯中的水分.某次生产误将甲苯当做苯投进反应釜中,由于甲苯中含水量少,最后反应釜还残留大量的Na.下列处理方法更合理、更安全的是( )
| A. | 打开反应釜,将Na 暴露在空气中与氧气反应 | |
| B. | 向反应釜通入Cl2,Na 在Cl2中燃烧生成NaCl | |
| C. | 向反应釜加大量H2O,通过化学反应“除掉”金属钠 | |
| D. | 向反应釜滴加C2H5OH,并设置放气管,排出氢气和热量 |
15.工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH) 2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
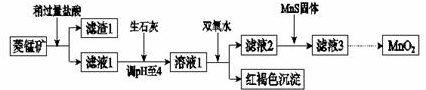
已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:□Mn2++□ClO3-+□4H2O=□Cl2↑+□5MnO2+□8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试 纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度,有利于Mn2+放电(不利于Cl-放电).

已知:生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:□Mn2++□ClO3-+□4H2O=□Cl2↑+□5MnO2+□8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试
 纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
纸置于阳极附近,若试纸变蓝则证明有Cl2生成.③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度,有利于Mn2+放电(不利于Cl-放电).
2.下列各选项有机物数目,与分子式为ClC4H7O2且能与碳酸氢钠反应生成气体的有机物数目相同的是(不含立体异构)( )
| A. | 分子式为C5H10的烯烃 | B. | 分子式为C4H8O2的酯 | ||
| C. | 甲苯(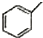 )的一氯代物 )的一氯代物 | D. | 立体烷( 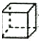 )的二氯代物 )的二氯代物 |
19.下列说法不正确的是( )
| A. | 氯气可用于自来水的消毒 | B. | 镁可用于制造信号弹和焰火 | ||
| C. | 氢氧化铁胶体能用于净水 | D. | 二氧化硫不可用于漂白纸浆 |
20.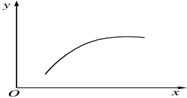 在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g)?2C(g)△H<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g)?2C(g)△H<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合图中曲线的是( )
 在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g)?2C(g)△H<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g)?2C(g)△H<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合图中曲线的是( )| 选项 | x | y |
| A | 温度 | 混合气体的平均相对分子质量 |
| B | 压强 | A的百分含量 |
| C | 再通入A | B的转化率 |
| D | 加入催化剂 | A的质量分数 |
| A. | A | B. | B | C. | C | D. | D |