题目内容
12.下列各离子组能在强酸性溶液中大量共存的是( )| A. | K+、Cl-、Fe3+、CO32- | B. | H+、Cl-、ClO-、Ca2+ | ||
| C. | Mg2+、Cl-、NO3-、K+ | D. | K+、ClO-、NO3-、Fe2+ |
分析 酸溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.酸溶液中不能大量存在CO32-,且Fe3+、CO32-相互促进水解不能共存,故A错误;
B.H+、Cl-、ClO-发生氧化还原反应,不能共存,故B错误;
C.酸溶液中该组离子之间不反应,可大量共存,故C正确;
D.酸溶液中ClO-、NO3-分别与Fe2+发生氧化还原反应,不能共存,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
2.下列说法正确的是( )
| A. | 纯净物是指由同种元素组成的物质 | B. | 由同种元素组成的纯净物叫单质 | ||
| C. | 由不同种分子组成的物质叫化合物 | D. | 一种元素只能组成一种单质 |
3.下列物质不能通过化合反应直接制得的是( )
| A. | SO2 | B. | H2SiO3 | C. | CuCl2 | D. | Fe﹙OH﹚3 |
20.下列反应属于取代反应的是( )
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | |
| B. | CH2=CH2+Br2→BrCH2CH2Br | |
| C. | CH3CH2CH2Cl+NaOH $→_{△}^{酸}$CH3CH=CH+NaCl+H2O | |
| D. | 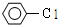 +H2O$→_{△}^{酸}$ +H2O$→_{△}^{酸}$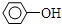 +HCl +HCl |
7.下列表示对应化学反应的离子方程式正确的是( )
| A. | 钠与CuSO4溶液反应:2Na+Cu=Cu↓+2Na+ | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
17.已知Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g)△H<0,下列叙述不正确的是( )
| A. | 该反应中旧键断裂吸收的总能量大于新键形成放出的总能量 | |
| B. | 反应物的总能量高于生成物的总能量 | |
| C. | 该反应为放热反应 | |
| D. | 该反应的化学能可以转化为电能 |
4.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:C2H6+7O2+8KOH=4K2CO3+10H2O,有关此电池的推断正确的是( )
| A. | 负极反应为:14H2O+7O2+28e-=28OH- | |
| B. | 放电一段时间后,负极周围的pH升高 | |
| C. | 放电过程中OH-向正极移动 | |
| D. | 每消耗1mol C2H6,则电路上转移的电子为14mol |
18.某厂用Na 除掉苯中的水分.某次生产误将甲苯当做苯投进反应釜中,由于甲苯中含水量少,最后反应釜还残留大量的Na.下列处理方法更合理、更安全的是( )
| A. | 打开反应釜,将Na 暴露在空气中与氧气反应 | |
| B. | 向反应釜通入Cl2,Na 在Cl2中燃烧生成NaCl | |
| C. | 向反应釜加大量H2O,通过化学反应“除掉”金属钠 | |
| D. | 向反应釜滴加C2H5OH,并设置放气管,排出氢气和热量 |