题目内容
14.某实验中需要500mL 0.2mol/L CuSO4溶液,实验室中用CuSO4来配制.(1)需要CuSO4的质量16g.
(2)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①溶解后转移有液体滴到容量瓶外偏低.
②定容时俯视偏高.
③开始时容量瓶中有水无影响.
分析 (1)配制0.2mol/L的CuSO4溶液500ml,需要CuSO4的物质的量=0.5L×0.2mol/L=0.1mol,根据m=nM进行计算;
(2)根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断.
解答 解:(1)配制0.2mol/L的CuSO4溶液500ml,需要CuSO4的物质的量=0.5L×0.2mol/L=0.1mol,所以质量为:0.1mol×160g/mol=16g,故答案为:16g;
(2)①溶解后转移有液体滴到容量瓶外,导致溶质的物质的是量减少,所以所配溶液浓度偏低,故答案为:偏低;
②定容时俯视,导致溶液的体积变小,所以配溶液的浓度偏高,故答案为:偏高;
③最终要加水定容,所以开始时容量瓶中有水,对所配溶液无影响,故答案为:无影响.
点评 本题考查了一定物质的量浓度溶液的配制过程、仪器以及误差分析,难度不大,注意实验的基本操作方法和注意事项.

练习册系列答案
相关题目
4.仅由C、H、O三种元素不能构成下列哪类物质( )
| A. | 油脂 | B. | 糖类 | C. | 蛋白质 | D. | 维生素 |
5.短周期主族元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.Y2+与X3-具有相同的电子层结构,X与Y、Z位于相邻的周期.下列说法正确的是( )
| A. | X的最高价氧化物对应的水化物是弱酸 | |
| B. | Z位于元素周期表的第3周期第ⅥA族 | |
| C. | Y的最高氧化物对应的水化物能溶于NaOH溶液 | |
| D. | 原子半径的大小顺序:r(Z)>r(Y)>r(X) |
2.下列说法正确的是( )
| A. | 纯净物是指由同种元素组成的物质 | B. | 由同种元素组成的纯净物叫单质 | ||
| C. | 由不同种分子组成的物质叫化合物 | D. | 一种元素只能组成一种单质 |
9.1LMgCl2溶液中含Cl-6.02×1023个,则溶液的物质的量浓度是( )
| A. | 0.5mol/L | B. | 1.0mol/L | C. | 1.5mol/L | D. | 3.0mol/L |
6.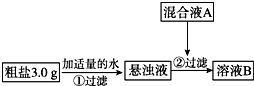 目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(如图称为粗盐)(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.
目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(如图称为粗盐)(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.
该小组设计流程如图:
(1)加入混合液A的主要成分是NaOH、Na2CO3 (填化学式).
(2)为检验溶液B中的Mg2+、Ca2+,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+,向其中一支试管中加入NaOH溶液(填化学式),看是否有沉淀生成.
步骤二:检验Ca2+,向另一支试管中加入某溶液,看是否有沉淀生成.下列三种溶液,其沉淀效果最好的是A.
A.0.1mol•L-1 Na2CO3溶液
B.0.1mol•L-1 Na2SO3溶液
C.0.1mol•L-1 Na2C2O4溶液
(3)在除杂过程中,向粗盐悬浊液中加混合液A时需控制溶液pH=12以确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在1.8×10-7mol•L-1以下.
(4)对溶液B加热并不断滴加6mol•L-1的盐酸,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C.该操作的目的是除去NaOH和Na2CO3.
(5)溶液C倒入蒸发皿中,加热蒸发并不断搅拌,直到有大量固体析出时停止加热.
(6)足量CaCO3固体分别加入:①30mL水 ②10mL 0.2mol/LNa2CO3溶液 ③50mL 0.01mol/L氯化钙溶液 ④100mL 0.01mol/L盐酸中溶解至溶液饱和.
请确定各溶液中Ca2+的浓度由大到小的顺序为:③④①②.
 目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(如图称为粗盐)(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.
目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(如图称为粗盐)(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.| 化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 6.8×10-8 | 4.0×10-9 | 1.8×10-11 |
(1)加入混合液A的主要成分是NaOH、Na2CO3 (填化学式).
(2)为检验溶液B中的Mg2+、Ca2+,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+,向其中一支试管中加入NaOH溶液(填化学式),看是否有沉淀生成.
步骤二:检验Ca2+,向另一支试管中加入某溶液,看是否有沉淀生成.下列三种溶液,其沉淀效果最好的是A.
A.0.1mol•L-1 Na2CO3溶液
B.0.1mol•L-1 Na2SO3溶液
C.0.1mol•L-1 Na2C2O4溶液
(3)在除杂过程中,向粗盐悬浊液中加混合液A时需控制溶液pH=12以确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在1.8×10-7mol•L-1以下.
(4)对溶液B加热并不断滴加6mol•L-1的盐酸,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C.该操作的目的是除去NaOH和Na2CO3.
(5)溶液C倒入蒸发皿中,加热蒸发并不断搅拌,直到有大量固体析出时停止加热.
(6)足量CaCO3固体分别加入:①30mL水 ②10mL 0.2mol/LNa2CO3溶液 ③50mL 0.01mol/L氯化钙溶液 ④100mL 0.01mol/L盐酸中溶解至溶液饱和.
请确定各溶液中Ca2+的浓度由大到小的顺序为:③④①②.
3.下列物质不能通过化合反应直接制得的是( )
| A. | SO2 | B. | H2SiO3 | C. | CuCl2 | D. | Fe﹙OH﹚3 |
4.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:C2H6+7O2+8KOH=4K2CO3+10H2O,有关此电池的推断正确的是( )
| A. | 负极反应为:14H2O+7O2+28e-=28OH- | |
| B. | 放电一段时间后,负极周围的pH升高 | |
| C. | 放电过程中OH-向正极移动 | |
| D. | 每消耗1mol C2H6,则电路上转移的电子为14mol |
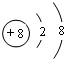 .
.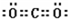 .
.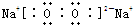 ,其中含有的化学键有离子键、共价键.用电子式表示B、D的单质在常温下反应生成的化合物的形成过程:
,其中含有的化学键有离子键、共价键.用电子式表示B、D的单质在常温下反应生成的化合物的形成过程: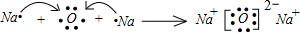 .
.