题目内容
16.已知常温下,CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20.现将Na2S晶体(含少量NaOH)加入CuSO4溶液中,充分搅拌,测得溶液的pH=4,则此时溶液则c(S2-)=4.0×10-36mol•L-1.分析 溶液中c(OH-)=10-10mol/L,代入Ksp[Cu(OH)2]计算溶液中c(Cu2+),再将c(Cu2+)代入Ksp(CuS)计算溶液中c( S2-).
解答 解:反应后测得溶液的pH=4,则溶液中c(OH-)=10-10mol/L,根据Ksp=c(Cu2+)×c2(OH-)=2.2×10-20,可得c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1{0}^{-10})^{2}}$mol/L=2.2mol/L,由Ksp=c(Cu2+)c(S2-)=8.8×10-36,可得此时溶液中c( S2-)=$\frac{8.8×1{0}^{-36}}{2.2}$mol/L=4.0×10-36mol/L,故答案为:4.0×10-36 .
点评 本题是实溶度积有关计算,是对基础知识的综合应用,题目难度中等.

练习册系列答案
相关题目
6.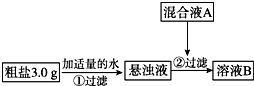 目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(如图称为粗盐)(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.
目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(如图称为粗盐)(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.
该小组设计流程如图:
(1)加入混合液A的主要成分是NaOH、Na2CO3 (填化学式).
(2)为检验溶液B中的Mg2+、Ca2+,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+,向其中一支试管中加入NaOH溶液(填化学式),看是否有沉淀生成.
步骤二:检验Ca2+,向另一支试管中加入某溶液,看是否有沉淀生成.下列三种溶液,其沉淀效果最好的是A.
A.0.1mol•L-1 Na2CO3溶液
B.0.1mol•L-1 Na2SO3溶液
C.0.1mol•L-1 Na2C2O4溶液
(3)在除杂过程中,向粗盐悬浊液中加混合液A时需控制溶液pH=12以确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在1.8×10-7mol•L-1以下.
(4)对溶液B加热并不断滴加6mol•L-1的盐酸,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C.该操作的目的是除去NaOH和Na2CO3.
(5)溶液C倒入蒸发皿中,加热蒸发并不断搅拌,直到有大量固体析出时停止加热.
(6)足量CaCO3固体分别加入:①30mL水 ②10mL 0.2mol/LNa2CO3溶液 ③50mL 0.01mol/L氯化钙溶液 ④100mL 0.01mol/L盐酸中溶解至溶液饱和.
请确定各溶液中Ca2+的浓度由大到小的顺序为:③④①②.
 目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(如图称为粗盐)(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.
目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(如图称为粗盐)(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.| 化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 6.8×10-8 | 4.0×10-9 | 1.8×10-11 |
(1)加入混合液A的主要成分是NaOH、Na2CO3 (填化学式).
(2)为检验溶液B中的Mg2+、Ca2+,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+,向其中一支试管中加入NaOH溶液(填化学式),看是否有沉淀生成.
步骤二:检验Ca2+,向另一支试管中加入某溶液,看是否有沉淀生成.下列三种溶液,其沉淀效果最好的是A.
A.0.1mol•L-1 Na2CO3溶液
B.0.1mol•L-1 Na2SO3溶液
C.0.1mol•L-1 Na2C2O4溶液
(3)在除杂过程中,向粗盐悬浊液中加混合液A时需控制溶液pH=12以确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在1.8×10-7mol•L-1以下.
(4)对溶液B加热并不断滴加6mol•L-1的盐酸,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C.该操作的目的是除去NaOH和Na2CO3.
(5)溶液C倒入蒸发皿中,加热蒸发并不断搅拌,直到有大量固体析出时停止加热.
(6)足量CaCO3固体分别加入:①30mL水 ②10mL 0.2mol/LNa2CO3溶液 ③50mL 0.01mol/L氯化钙溶液 ④100mL 0.01mol/L盐酸中溶解至溶液饱和.
请确定各溶液中Ca2+的浓度由大到小的顺序为:③④①②.
7.下列表示对应化学反应的离子方程式正确的是( )
| A. | 钠与CuSO4溶液反应:2Na+Cu=Cu↓+2Na+ | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
4.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:C2H6+7O2+8KOH=4K2CO3+10H2O,有关此电池的推断正确的是( )
| A. | 负极反应为:14H2O+7O2+28e-=28OH- | |
| B. | 放电一段时间后,负极周围的pH升高 | |
| C. | 放电过程中OH-向正极移动 | |
| D. | 每消耗1mol C2H6,则电路上转移的电子为14mol |
11.下列关于元素周期表的说法正确的是( )
| A. | 过渡元素全部都是副族元素 | |
| B. | 短周期共有32 种元素 | |
| C. | 科学研究时,经常在过渡元素中寻找耐高温、耐腐蚀的合金材料 | |
| D. | 元素周期表共七个横行代表七个周期,18 个纵横代表18 个族 |
1.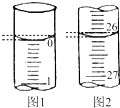 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:
(1)滴定时一般左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶,直到加入最后一滴盐酸,溶液溶液颜色由红色变为无色,且半分钟内不变色,即达到滴定终点.若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸的体积为26.10 mL.
(2)某学生重复三次实验,记录数据如下表所示(待测NaOH溶液的体积均为25.00mL);
计算所测氢氧化钠溶液的物质的量浓度为0.1044 mol/L(保留四位小数)
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏高的是AC.
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴处在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定开始时仰视读数,滴定结束时俯视读数.
 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:(1)滴定时一般左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶,直到加入最后一滴盐酸,溶液溶液颜色由红色变为无色,且半分钟内不变色,即达到滴定终点.若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸的体积为26.10 mL.
(2)某学生重复三次实验,记录数据如下表所示(待测NaOH溶液的体积均为25.00mL);
| 滴定次数 | 0.1000mol-L-1盐酸的体积/mL | ||
| 滴定前 | 滴定后 | 体积/mL | |
| 1 | 0.10 | 26.21 | 26.11 |
| 2 | 1.56 | 31.30 | 29.74 |
| 3 | 0.22 | 26.31 | 26.09 |
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏高的是AC.
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴处在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定开始时仰视读数,滴定结束时俯视读数.
2.下列各选项有机物数目,与分子式为ClC4H7O2且能与碳酸氢钠反应生成气体的有机物数目相同的是(不含立体异构)( )
| A. | 分子式为C5H10的烯烃 | B. | 分子式为C4H8O2的酯 | ||
| C. | 甲苯(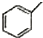 )的一氯代物 )的一氯代物 | D. | 立体烷( 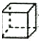 )的二氯代物 )的二氯代物 |