题目内容
16.Na2S2O3在化学定量分析中常用作基准物质,遇酸易分解;实验室制备原理为2Na2S+Na2CO3+4SO2$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S2O3+CO2.实验装置如下: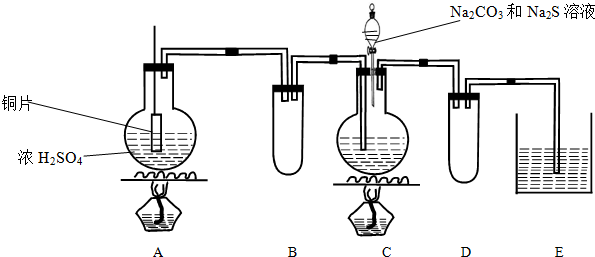
(1)A中发生反应的化学方程式是:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O.
(2)E中所盛试剂作用是吸收尾气防止污染环境;若要停止A中的化学反应,还可以采取的操作是将铜片抽离液面或停止加热.
(3)B和D装置作用:作安全瓶,防止C、E中的溶液倒吸进入A、C中.
(4)甲同学在加热A后,发现液面下的铜丝变黑.该同学对黑色生成物提出如下假设:
①可能是CuO;②可能是Cu2O;③可能是CuS
乙同学认为假设②?一定不成立,依据是Cu2O呈砖红色.
该同学设计实验进一步验证黑色物质的组成:
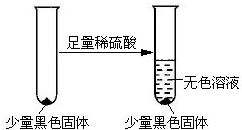
基于上述假设分析,黑色物质的组成为(填化学式)CuS.
(5)C中通入SO2不能过量原因是硫代硫酸钠在酸性溶液中不稳定易分解.
(6)实验室用硫代硫酸钠溶液吸收残余氯气生成SO42-,其反应的离子方程式是:S2O32-+5H2O+4Cl2═2SO42-+8Cl-+10H+.
分析 (1)Cu与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫与水;
(2)(3)A装置制备二氧化硫,C装置中合成Na2S2O3,会导致装置内气压减小,B装置为安全瓶作用,二氧化硫有毒,会污染空气,E装置中可以盛放氢氧化钠溶液吸收剩余的二氧化硫,D装置为安全瓶,防止溶液倒吸;
(4)Cu2O呈砖红色,不可能为Cu2O;黑色固体不溶液硫酸,应是CuS;
(5)由题目信息可知,Na2S2O3遇酸易分解;
(6)用硫代硫酸钠溶液吸收残余氯气生成SO42-,氯气被还原为氯离子,配平书写离子方程式.
解答 解:A装置制备二氧化硫,C装置中合成Na2S2O3,会导致装置内气压减小,B装置为安全瓶作用,二氧化硫有毒,会污染空气,E装置中可以盛放氢氧化钠溶液吸收剩余的二氧化硫,D装置为安全瓶,防止溶液倒吸.
(1)Cu与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫与水,反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O;
(2)E中所盛试剂作用是:吸收尾气防止污染环境,
若要停止A中的化学反应,还可以采取的操作是:将铜片抽离液面或停止加热,
故答案为:吸收尾气防止污染环境;将铜片抽离液面或停止加热;
(3)B和D装置作用:作安全瓶,防止C、E中的溶液倒吸进入A、C中,
故答案为:作安全瓶,防止C、E中的溶液倒吸进入A、C中;
(4)乙同学认为假设②?一定不成立,依据是:Cu2O呈砖红色,设计实验进一步验证黑色物质,黑色固体不溶液硫酸,CuO能与硫酸反应,CuS不溶于硫酸,故黑色物质为CuS,
故答案为:Cu2O呈砖红色;CuS;
(5)二氧化硫过量,会得到亚硫酸,Na2S2O3遇酸易分解,故二氧化硫不能过量,
故答案为:硫代硫酸钠在酸性溶液中不稳定易分解;
(6)用硫代硫酸钠溶液吸收残余氯气生成SO42-,氯气被还原为氯离子,反应离子方程式为:S2O32-+5H2O+4Cl2═2SO42-+8Cl-+10H+,
故答案为:S2O32-+5H2O+4Cl2═2SO42-+8Cl-+10H+.
点评 本题考查物质制备实验,涉及对装置的分析评价、探究实验、题目信息应用、离子方程式书写等,注意对物质性质掌握,是对学生综合能力考查,培养学生的实验能力、分析能力与知识迁移运用能力,难度中等.

| A. | 糖类、油脂和蛋白质都是高分子化合物 | |
| B. | 乙醇和乙酸都能与金属钠反应生成氢气 | |
| C. | 淀粉(C6H10O5)n和纤维素(C6H10O5)n互为同分异构体 | |
| D. | 石油的分馏和煤的干馏均只发生物理变化 |
| 选项 | 实验操作 | 实验目的 |
| A | 向甲酸钠溶液中加新制的Cu(OH)2并加热 | 确定甲酸钠具有醛基性质 |
| B | 加溴水,振荡,过滤除去沉淀 | 除去苯中混有的苯酚 |
| C | 给碳酸钠溶液中加入浓盐酸,将产生的气体通入苯酚钠溶液 | 验证酸性: 盐酸>碳酸>苯酚 |
| D | 氯乙烷和氢氧化钠的乙醇溶液共热,将产生的气体通入酸性高锰酸钾溶液 | 验证产生的气体为乙烯 |
| A. | A | B. | B | C. | C | D. | D |
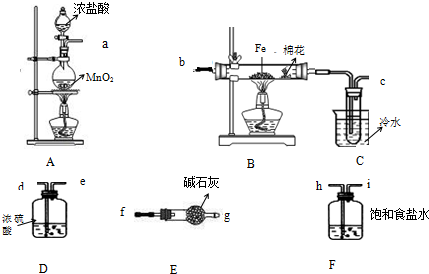
(1)不加热条件下检查A装置气密性的操作方法是将管口a封闭,向分液漏斗中注入水,打开分液漏斗活塞,水的液面不会连续下降,证明装置A的气密性良好.
(2)制备开始时A装置烧瓶中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)按气流方向连接完整装置:a→h→i→d→e→b→c→f→g(按仪器接口字母编号)
(4)若无E装置可能产生的后果是未反应的氯气污染空气,空气中的水可使无水FeCl3水解.
(5)本实验合理的操作步骤为②③①④⑥⑤(按操作顺序选择序号).
①添加药品 ②连接仪器 ③检查装置气密性 ④点燃A处酒精灯
⑤点燃B处酒精灯 ⑥使B中硬质玻璃管内充满黄绿色气体
(6)实验完毕后该组同学将B装置玻璃管内的残留物溶于水,对所得溶液中的阳离子提出以下假设并设计实验进行相关证明,完成横线上的内容,并将答案分别填入答题卡中甲、乙、丙、丁处.
| 提出假设 | 加入试剂及操作 | 实验现象 | 得出结论 |
| 假设1:含Fe2+(甲) | 取少许溶液少许,先滴入KSCN溶液,然后再滴入几滴氯水(乙) | 溶液先无明显变化,后变为血红色 | 含该离子 |
| 假设2:含Fe3+ | 滴入几滴KSCN溶液 | 溶液变为血红色 | 含Fe3+ |
| 假设3:含Fe2+、Fe3+ | 取A、B两等份溶液少许,A加入少量高锰酸钾溶液(丙); B加入KSCN溶液 | A溶液紫色退为无色(丁),B溶液变为血红色 | 二者都存在 |
| A. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| B. | 饱和小苏打溶液中:c(Na+)=c(HCO3-) | |
| C. | pH=4的醋酸中:c(H+)=4.0mol•L-1 | |
| D. | pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol•L-1 |
| A. | Mg2+的结构示意图: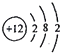 | |
| B. | 乙酸的结构简式:CH3CH2OH | |
| C. | 硫酸钾的电离方程式:K2SO4═K2++SO${\;}_{4}^{2-}$ | |
| D. | CO2的电子式: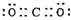 |
| A. | 氧化物:CO | B. | 酸:NaHSO4 | C. | 碱:纯碱 | D. | 铵盐:NH3•H2O |