题目内容
11.(一)某课外实验活动小组拟用下列装置和药品制备无水氯化铁晶体,该物质极易潮解,100℃左右时升华,完成下列问题: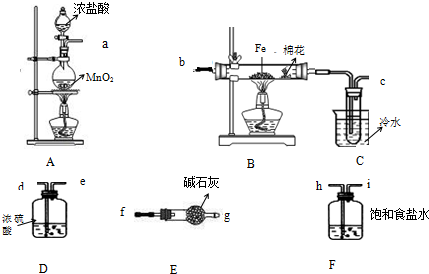
(1)不加热条件下检查A装置气密性的操作方法是将管口a封闭,向分液漏斗中注入水,打开分液漏斗活塞,水的液面不会连续下降,证明装置A的气密性良好.
(2)制备开始时A装置烧瓶中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)按气流方向连接完整装置:a→h→i→d→e→b→c→f→g(按仪器接口字母编号)
(4)若无E装置可能产生的后果是未反应的氯气污染空气,空气中的水可使无水FeCl3水解.
(5)本实验合理的操作步骤为②③①④⑥⑤(按操作顺序选择序号).
①添加药品 ②连接仪器 ③检查装置气密性 ④点燃A处酒精灯
⑤点燃B处酒精灯 ⑥使B中硬质玻璃管内充满黄绿色气体
(6)实验完毕后该组同学将B装置玻璃管内的残留物溶于水,对所得溶液中的阳离子提出以下假设并设计实验进行相关证明,完成横线上的内容,并将答案分别填入答题卡中甲、乙、丙、丁处.
| 提出假设 | 加入试剂及操作 | 实验现象 | 得出结论 |
| 假设1:含Fe2+(甲) | 取少许溶液少许,先滴入KSCN溶液,然后再滴入几滴氯水(乙) | 溶液先无明显变化,后变为血红色 | 含该离子 |
| 假设2:含Fe3+ | 滴入几滴KSCN溶液 | 溶液变为血红色 | 含Fe3+ |
| 假设3:含Fe2+、Fe3+ | 取A、B两等份溶液少许,A加入少量高锰酸钾溶液(丙); B加入KSCN溶液 | A溶液紫色退为无色(丁),B溶液变为血红色 | 二者都存在 |
分析 (1)装置处于封闭状态,如果装置气密性良好,用分液漏斗向圆底烧瓶内加水,分液漏斗的水的液面不会连续下降;
(2)A中二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水;
(3)A装置制备氯气,制备的氯气中含有HCl、水蒸气,用饱和食盐水除去HCl,氯化铁易水解,进入B装置的氯气应干燥,应浓硫酸干燥氯气,氯化铁在100℃左右时升华,B中反应得到氯化铁为气态,利用冷水冷却收集氯化铁晶体,氯气有毒,剩余的氯气用碱石灰吸收,防止污染空气,碱石灰还可以吸收空气中水蒸气,防止C中氯化铁水解;
(4)碱石灰吸收剩余的氯气,吸收空气中水蒸气,防止C中氯化铁水解;
(5)先连接仪器,再检验装置气密性,然后添加药品,加热制备氯气,用氯气排尽装置中空气,防止铁被氧气氧化,再叫加热制备氯化铁;
(6)阳离子可能为Fe2+,或者为Fe3+,或者二者都有;
若只含有Fe2+,先加入KSCN溶液,没有明显现象,再滴入几滴氯水,溶液变为红色;
如含有Fe2+、Fe3+,利用KSCN溶液检验铁离子,亚铁离子检验还原性,利用高锰酸钾溶液检验亚铁离子.
解答 解:(1)不加热条件下检查A装置气密性的操作方法是:将管口a封闭,向分液漏斗中注入水,打开分液漏斗活塞,水的液面不会连续下降,证明装置A的气密性良好,
故答案为:将管口a封闭,向分液漏斗中注入水,打开分液漏斗活塞,水的液面不会连续下降,证明装置A的气密性良好;
(2)A中二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水,反应离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)A装置制备氯气,制备的氯气中含有HCl、水蒸气,用饱和食盐水除去HCl,氯化铁易水解,进入B装置的氯气应干燥,应浓硫酸干燥氯气,氯化铁在100℃左右时升华,B中反应得到氯化铁为气态,利用冷水冷却收集氯化铁晶体,氯气有毒,剩余的氯气用碱石灰吸收,防止污染空气,碱石灰还可以吸收空气中水蒸气,防止C中氯化铁水解,按气流方向连接完整装置:a→h→i→d→e→b→c→f→g,
故答案为:h;i;d;e;f;g;
(4)碱石灰吸收剩余的氯气,吸收空气中水蒸气,若无E装置可能产生的后果是:未反应的氯气污染空气,空气中的水可使无水FeCl3水解,
故答案为:未反应的氯气污染空气,空气中的水可使无水FeCl3水解;
(5)先连接仪器,再检验装置气密性,然后添加药品,加热制备氯气,用氯气排尽装置中空气,防止铁被氧气氧化,再叫加热制备氯化铁,操作步骤为:②③①④⑥⑤,
故答案为:②③①④⑥⑤;
(6)阳离子可能为Fe2+,或者为Fe3+,或者二者都有;
若只含有Fe2+,先加入KSCN溶液,没有明显现象,再滴入几滴氯水,溶液变为红色;
如含有Fe2+、Fe3+,滴入KSCN溶液,溶液变红色,证明含有离子,亚铁离子检验还原性,滴入高锰酸钾溶液,紫色退为无色,证明含有亚铁离子,
故答案为:
| 提出假设 | 加入试剂及操作 | 实验现象 | 得出结论 |
| 假设1:含 Fe2+(甲) | 取少许溶液少许,先滴入KSCN溶液,然后再滴入几滴氯水(乙) | 溶液先无明显变化,后变为血红色 | 含该离子 |
| 假设2:含Fe3+ | 滴入几滴KSCN溶液 | 溶液变为血红色 | 含Fe3+ |
| 假设3:含Fe2+、Fe3+ | 取A、B两等份溶液少许,A加入 少量高锰酸钾溶液(丙); B加入KSCN溶液 | A溶液 紫色退为无色(丁),B溶液变为血红色 | 二者都存在 |
点评 本题考查物质制备实验,涉及气密性检验、对装置与操作的分析评价、离子检验等,关键是理解制备原理,明确各装置作用,难度中等.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案| A. | 将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 | |
| B. | 室温下,测1 mol/L NaX溶液的pH,若pH>7,证明HX是弱酸 | |
| C. | 室温下,测0.1 mol/L HX溶液的pH,若pH>1,证明HX是弱酸 | |
| D. | 相同条件下,对0.1 mol/L的HCl和0.1 mol/L的HX进行导电性实验,若与HX溶液相串联的灯泡较暗,证明HX为弱酸 |
| A. | 两溶液加入等质量的锌粉,产生氢气的速率相同 | |
| B. | 两溶液中氢氧根离子浓度均为10-13 mol/L | |
| C. | 加入醋酸钠固体,二者的pH均增大 | |
| D. | 恰好完全反应时,二者消耗氢氧化钠的质量相同 |
| A. | 乙烷的沸点低于甲烷,密度大于甲烷 | |
| B. | 相对分子质量相近的醇和烷烃,醇的沸点远高于烷烃 | |
| C. | 苯酚在任何温度下,均微溶于水 | |
| D. | 酯在碱性条件下的水解反应均为皂化反应 |
| A. | 单位时间内消耗1molH2,同时生成2molHI | |
| B. | 每断裂AmolH-I,同时有$\frac{A}{2}$molH-H断裂 | |
| C. | 容器中压强不再变化 | |
| D. | 容器中混合气体的密度不再变化 |
Ⅰ、向一定量样品中加入过量盐酸,产生气体A.
Ⅱ、向Ⅰ中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤.
Ⅲ、向沉淀B中加过量NaOH溶液,沉淀全部溶解.
Ⅳ、向Ⅱ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C.
已知:Al3+在pH=5.0时沉淀完全:Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全.且有n(A):n(B):n(C)=2:2:3,则该碱式碳酸铝镁的化学式为( )
| A. | Mg2Al2(OH)4(CO3)3 | B. | Mg3Al2(OH)6(CO3)2 | C. | Mg3Al(OH)3(CO3)3 | D. | Mg3Al2(OH)8(CO3)2 |
 氮元素可形成多种金属氮化物,如氮化钠(Na3N)、氮化镁(Mg3N2)和叠氮化钠(NaN3)等.
氮元素可形成多种金属氮化物,如氮化钠(Na3N)、氮化镁(Mg3N2)和叠氮化钠(NaN3)等.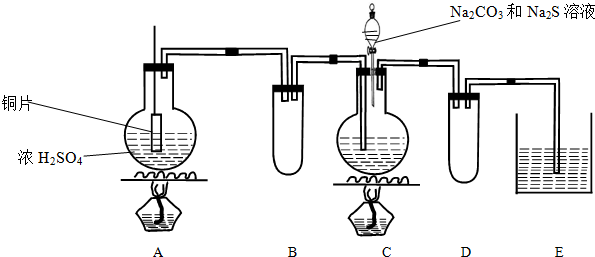
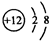 ;O的电子式为
;O的电子式为 ;H2S的结构式为H-S-H.
;H2S的结构式为H-S-H.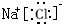 ,溶于水发生电离的电离方程式为NaCl=Na++Cl-,向氯化钠溶液中滴入硝酸银时发生反应的离子方程式为Ag++Cl-=AgCl↓.
,溶于水发生电离的电离方程式为NaCl=Na++Cl-,向氯化钠溶液中滴入硝酸银时发生反应的离子方程式为Ag++Cl-=AgCl↓.