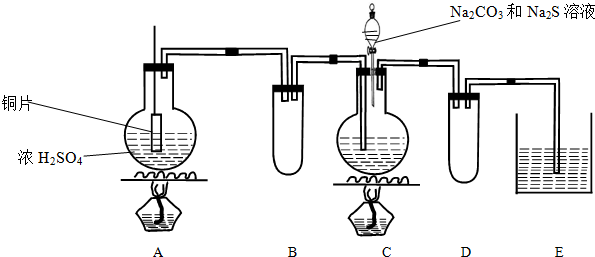
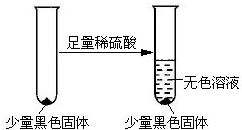
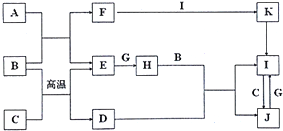
题目内容
8.下列化学用语表示正确的是( )| A. | Mg2+的结构示意图: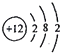 | |
| B. | 乙酸的结构简式:CH3CH2OH | |
| C. | 硫酸钾的电离方程式:K2SO4═K2++SO${\;}_{4}^{2-}$ | |
| D. | CO2的电子式: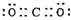 |
分析 A.Mg2+的质子数为12,电子数为10,用小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数;
B.CH3CH2OH为乙醇的结构简式;
C.硫酸钾电离出钾离子和硫酸根离子,钾离子书写错误,角标应为系数;
D.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子.
解答 解:A.Mg2+的质子数为12,电子数为10,离子结构示意图为: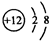 ,故A错误;
,故A错误;
B.乙酸的分子式为:C2H4O2,结构简式为CH3COOH,故B错误;
C.硫酸钾电离出钾离子和硫酸根离子,电离方程式:K2SO4═2K++SO42-,故C错误;
D.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故D正确;
,故D正确;
故选D.
点评 本题考查了常用化学用语的规范,掌握离子结构、电解质的电离、电子式的书写是解答关键,题目比较简单.

练习册系列答案
相关题目
4.下列反应中,属于加成反应的是( )
| A. | C2H6+Cl2→C2H5Cl+HCl | B. | CH2═CH2+H2O→CH3CH2OH | ||
| C. |  +HO-NO2→ +HO-NO2→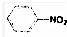 +H2O +H2O | D. | CH3CH2Cl+NaOH→CH2═CH2+NaCl+H2O |
3.一定温度下,在2L的密闭容器中,冲入1molHI气体,能说明反应2HI(g)?H2(g)+I2(g)达到平衡状态的标志是( )
| A. | 单位时间内消耗1molH2,同时生成2molHI | |
| B. | 每断裂AmolH-I,同时有$\frac{A}{2}$molH-H断裂 | |
| C. | 容器中压强不再变化 | |
| D. | 容器中混合气体的密度不再变化 |
20.为确定某种抗酸药-碱式碳酸铝镁[MgaAlb(OH)c(CO3)d]的组成,进行如下实验:
Ⅰ、向一定量样品中加入过量盐酸,产生气体A.
Ⅱ、向Ⅰ中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤.
Ⅲ、向沉淀B中加过量NaOH溶液,沉淀全部溶解.
Ⅳ、向Ⅱ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C.
已知:Al3+在pH=5.0时沉淀完全:Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全.且有n(A):n(B):n(C)=2:2:3,则该碱式碳酸铝镁的化学式为( )
Ⅰ、向一定量样品中加入过量盐酸,产生气体A.
Ⅱ、向Ⅰ中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤.
Ⅲ、向沉淀B中加过量NaOH溶液,沉淀全部溶解.
Ⅳ、向Ⅱ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C.
已知:Al3+在pH=5.0时沉淀完全:Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全.且有n(A):n(B):n(C)=2:2:3,则该碱式碳酸铝镁的化学式为( )
| A. | Mg2Al2(OH)4(CO3)3 | B. | Mg3Al2(OH)6(CO3)2 | C. | Mg3Al(OH)3(CO3)3 | D. | Mg3Al2(OH)8(CO3)2 |
17.化学与人类生成、生活、社会可持续发展密切相关.下列说法不正确的是( )
| A. | 将“地沟油”反应改性制成“生物柴油”,代替柴油作为内燃机燃料的做法符合“绿色化学”的理念 | |
| B. | 红宝石、玛瑙、水晶、钻石等装饰品的主要成分都是硅酸盐 | |
| C. | 科学家推测月尘[即月球上直径小于10微米(1μm=1×10-6m)的浮尘]是“玉兔号”出现控制异常情况的主要原因,月尘在空气中形成的分散系不属于胶体 | |
| D. | “煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气 |
18.工业上制备纯硅反应的热化学方程式:SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=+QkJ/mol(Q>0),一定温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
| A. | 反应过程中,若减小压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ | |
| C. | 反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L•min) | |
| D. | 当反应吸收热量为0.5QkJ时,生成的HCl通入1L 1mol/L的NaOH溶液恰好完全反应 |
 氮元素可形成多种金属氮化物,如氮化钠(Na3N)、氮化镁(Mg3N2)和叠氮化钠(NaN3)等.
氮元素可形成多种金属氮化物,如氮化钠(Na3N)、氮化镁(Mg3N2)和叠氮化钠(NaN3)等.