题目内容
5.原子的电子排布为[Ar]3d54s2的元素位于( )| A. | s区 | B. | p区 | C. | d区 | D. | f区 |
分析 外围电子排布为3d54s2的元素,原子核外电子排布式为[Ar]3d54s2的元素,其质子数为25,为Mn元素,处于周期表中第四周期ⅦB族.
解答 解:核外电子最后排入的能级为3d,属于d区元素,故选C.
点评 本题考查原子结构与位置关系、元素周期表等,难度不大,注意理解核外电子排布规律,掌握根据原子序数判断元素在周期表的位置方法.

练习册系列答案
相关题目
14.对于反应N2+O2?2NO在密闭容器中进行,下列哪些条件能加快反应的速率( )
| A. | 缩小体积使压强增大 | B. | 体积不变充入稀有气体使压强增大 | ||
| C. | 体积不变充入He使压强增大 | D. | 压强不变充入稀有气体氖 |
10.如表是A、B、C、D、E五种有机物的有关信息:
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学反应方程式nCH2=CH2→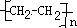 .
.
(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与KMnO4酸性溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: .
.
(4)C与E反应生成相对分子质量为100的酯,该反应类型为酯化反应或取代反应;其化学反应方程式为CH3CH2OH+CH2=CHCOOH$?_{△}^{浓硫酸}$CH2=CHCOOCH2CH3+H2O.
(5)写出由C氧化生成D的化学反应方程式:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成; ②球棍模型为: 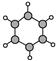 |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. |
| D | ①相对分子质量比C少2; ②能由C氧化而成; |
| E | ①由C、H、O三种元素组成; ②球棍模型为: 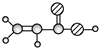 |
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学反应方程式nCH2=CH2→
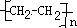 .
.(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与KMnO4酸性溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
.(4)C与E反应生成相对分子质量为100的酯,该反应类型为酯化反应或取代反应;其化学反应方程式为CH3CH2OH+CH2=CHCOOH$?_{△}^{浓硫酸}$CH2=CHCOOCH2CH3+H2O.
(5)写出由C氧化生成D的化学反应方程式:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
17.下列有关原电池的判断错误的是( )
①所有金属都能作电极
②有活泼性不同的两种金属电极、有电解质溶液、导线就一定能构成原电池,对外放电
③原电池放电实现化学能转化为电能
④以锌、铜为电极,在稀硫酸溶液中构成原电池,正极反应式为Zn-2e-═Zn2+.
①所有金属都能作电极
②有活泼性不同的两种金属电极、有电解质溶液、导线就一定能构成原电池,对外放电
③原电池放电实现化学能转化为电能
④以锌、铜为电极,在稀硫酸溶液中构成原电池,正极反应式为Zn-2e-═Zn2+.
| A. | ①② | B. | ①③ | C. | ①②④ | D. | ①②③④ |
14.下列实验对应的结论不正确的是( )
| A. | 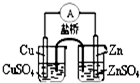 能组成Zn、Cu原电池 | B. |  能证明非金属性C>Si | ||
| C. | 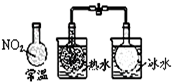 说明反应2NO2?N2O4△H>0 | D. | 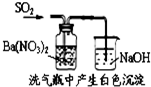 白色沉淀为BaSO4 |
15.100mL 6mol•L-1的H2SO4跟过量锌粉反应,在一定温度下,要想减缓反应进行的速率,但又不影响生成的氢气的总量,可向反应物中加入适量的( )
| A. | 适量浓H2SO4 | B. | 硫酸钾固体 | C. | 醋酸钠固体 | D. | 硝酸钾溶液 |
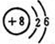
 (3)镁离子Mg2+(4)硫离子
(3)镁离子Mg2+(4)硫离子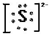 .
.
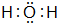 、
、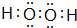 ,属于共价化合物.
,属于共价化合物.