题目内容
16.写出下列物质或微粒的电子式(1)H2H:H (2)N2
 (3)镁离子Mg2+(4)硫离子
(3)镁离子Mg2+(4)硫离子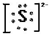 .
.
分析 (1)氢气中两个氢原子通过共用1对电子达到稳定结构;
(2)氮气中存在3对共用电子对,氮原子最外层达到8个电子;
(3)金属阳离子的电子式即为离子符号;
(4)S2-原子核外最外层有8个电子.
解答 解:(1)氢气中两个氢原子通过共用1对电子达到稳定结构,氢气的电子式为H:H,故答案为:H:H;
(2)氮气中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为 ,故答案为:
,故答案为: ;
;
(3)Mg2+的电子式为Mg2+,故答案为:Mg2+;
(4)S2-原子核外最外层有8个电子,电子式为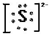 ,故答案为:
,故答案为: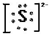 .
.
点评 本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.

练习册系列答案
相关题目
1.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )


| A. | 反应CH4+H2O $\frac{\underline{催化剂}}{△}$3H2+CO,每消耗1 mol CH4转移12 mol电子 | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-═2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- |
5.原子的电子排布为[Ar]3d54s2的元素位于( )
| A. | s区 | B. | p区 | C. | d区 | D. | f区 |
6.有以下四种微粒14N、15N、N2、N4(结构为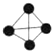 ),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
 ),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )| A. | 14N2与15N2互为同位素,N4与N2互为同素异形体 | |
| B. | N4属于一种新型的化合物 | |
| C. | 14N与15N化学性质不相同 | |
| D. | 1mol N4气体完全转变为N2将放出882kJ热量 |
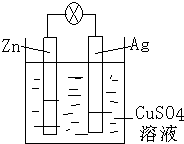 如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液,回答下列问题:
如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液,回答下列问题: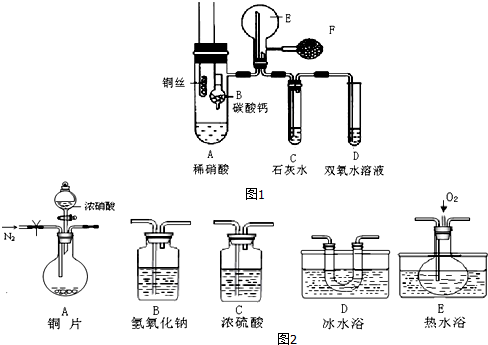
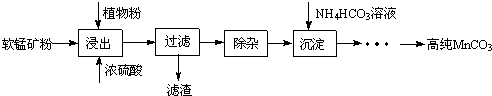
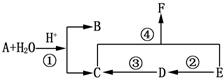
 .
.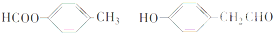 ;
;