题目内容
15.100mL 6mol•L-1的H2SO4跟过量锌粉反应,在一定温度下,要想减缓反应进行的速率,但又不影响生成的氢气的总量,可向反应物中加入适量的( )| A. | 适量浓H2SO4 | B. | 硫酸钾固体 | C. | 醋酸钠固体 | D. | 硝酸钾溶液 |
分析 适当降低氢离子浓度、将Zn换为不如Zn活泼且能与氢离子反应生成氢气的金属能减缓反应速率,不影响生成氢气总量,则酸最终电离出氢离子总量不变,据此分析解答.
解答 解:A.加入适量浓硫酸,硫酸浓度增大,加快反应速率且生成氢气总量增大,故A错误;
B.加入硫酸钾固体,氢离子浓度不变,则反应速率不变,故B错误;
C.加入醋酸钠固体,溶液中氢离子浓度降低,反应速率降低,但最终电离出氢离子物质的量不变,则生成氢气总量不变,故C正确;
D.加入硝酸钾溶液,硝酸和锌反应不生成氢气而生成氮氧化物,故D错误;
故选C.
点评 本题考查化学反应速率影响因素,为高频考点,明确浓度、物质性质是解本题关键,易错选项是D,注意D中隐含条件,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.原子的电子排布为[Ar]3d54s2的元素位于( )
| A. | s区 | B. | p区 | C. | d区 | D. | f区 |
6.有以下四种微粒14N、15N、N2、N4(结构为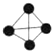 ),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
 ),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )| A. | 14N2与15N2互为同位素,N4与N2互为同素异形体 | |
| B. | N4属于一种新型的化合物 | |
| C. | 14N与15N化学性质不相同 | |
| D. | 1mol N4气体完全转变为N2将放出882kJ热量 |
10.下列物质性质的比较中,正确的是( )
| A. | 氢化物稳定性:HBr>HCl>PH3 | B. | 离子半径:Na+>Cl->F- | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 离子的还原性 Cl>Br>I |
20.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,1.12L CCl4中含有C-Cl键数目为0.2NA | |
| B. | 标准状况下,2.24L氯气中含有${\;}_{17}^{35}$Cl数目一定为0.2NA | |
| C. | 常温常压下,4.4g CO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 80 mL 10 mol•L-1 盐酸与足量MnO2加热反应,产生Cl2的体积为4.48L |
7.对化学反应限度的叙述错误的是( )
| A. | 任何可逆反应都有一定的限度 | |
| B. | 化学反应的限度是不可改变的 | |
| C. | 化学反应达到限度时,各物质的浓度不再改变 | |
| D. | 化学反应达到限度时,正逆反应速率相等 |
4.对于可逆反应M+N?Q达到平衡时,下列说法正确的是( )
| A. | M、N、Q三种物质的浓度一定相等 | B. | 反应已经停止 | ||
| C. | 各组分的浓度保持不变 | D. | M、N全部变成了Q |


 .
. .
.