题目内容
1.某酸性工业废水中含有SO${\;}_{4}^{2-}$、Na+、Al3+、Fe3+、Fe2+、Cu2+、Au3+、NH${\;}_{4}^{+}$等离子.我们可用常见的稀酸和烧碱溶液及废铁屑为原料把金(Au)等从废水中回收制取.设计工艺流程及转化如图:
据对上图的分析填写下面空白
(1)图中标号处①和⑧需加入的物质分别为NaOH、稀H2SO4 .
(2)写出⑤处发生的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
写出⑦处发生的化学方程式:2Al+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+Al2O3.
写出②处发生的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
写出⑩处发生的离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(3)向上述J溶液中加入一定量的Fe、Al粉混合物充分反应后,反应体系会出现的情况可能是(填编号)a、b、e.
a.Al3+、Fe3+、Cu2+、无固体
b.Al3+、Fe3+、Fe2+、Cu2+、无固体
c.Al3+、Fe3+、析出Cu
d.Al3+、Fe2+、Cu2+、析出Fe
e.Al3+、Fe2+、析出Cu
(4)若向该工业废水中加入Na2O2固体,充分反应后,再加入过量的盐酸,则该溶液中的离子数目没有变化的是SO42-、Al3+、Cu2+(不考虑Au3+)
分析 某酸性工业废水中含有SO42-、Na+、Al3+、Fe3+、Fe2+、Cu2+、Au3+、NH4+等离子,加入过量铁粉过滤得到滤液A为SO42-、Na+、Al3+、NH4+、Fe2+,滤渣G为Fe、Cu、Au,在滤液A中加入过量氢氧化钠溶液过滤得到滤液B为SO42-、Na+、NH3•H2O、NaAlO2,通入过量二氧化碳反应过滤得到沉淀为C为Al(OH)3,反应③为氢氧化铝分解得到氧化铝,D为Al2O3,反应④为电解熔融氧化铝,Q为SO42-、Na+、NH4+、HCO3-,过滤得到E为Fe(OH)2,在空气中防止得到F为氢氧化铁,加热分解发生反应⑥得到氧化铁,反应⑦是铝热反应,铝和氧化铁反应生铁和氧化铝,G中加入过量稀硫酸溶解铁,过滤得到I为Cu和Au,H为硫酸亚铁,I中加入过量稀硝酸溶解铜为硝酸铜,过滤得到金和滤液硝酸铜溶液,加入碱沉淀铜离子,生成氢氧化铜沉淀,反应为氢氧化铜分解生成氧化铜和水,
(1)图中标号处①和⑧需加入的物质分别为NaOH、稀H2SO4 ;
(2)⑤处发生的反应为Fe(OH)2在空气中被氧化为氢氧化铁,⑦处发生的反应为铝热反应,铝和氧化铁反应生铁和氧化铝,②处发生的反应为过滤二氧化碳和偏铝酸钠溶液反应生成氢氧化铝沉淀和碳酸氢钠,⑩处发生的反应为铜和稀硝酸反应生成一氧化氮、硝酸铜和水;
(3)J溶液为过量的硝酸,硝酸铜溶液,加入一定量的Fe、Al粉混合物充分反应后,可能发生的反应依据还原性顺序为Al>Fe>Cu,氧化性HNO3>Cu2+>H+,结合定量关系分析判断可能存在的离子和固体;
(4)溶液中加入过量的Na2O2固体,与水反应生成NaOH和氧气,放出热量,钠离子增大,Fe2+被氧化成Fe3+,Fe2+减少;Fe3+、Al3+、Cu2+、NH4+均与碱反应,铝离子转化为偏铝酸根离子,Fe3+转化为氢氧化铁,Cu2+转化为Cu(OH)2、NH4+转化为一水合氨和氨气,故NH4+减少;再通入过量的稀盐酸,溶液中氢氧化铁转化为铁离子,铁离子增多,偏铝酸根离子转化为铝离子,铝离子,硫酸根离子和铜离子保持不变,依此进行判断.
解答 解:某酸性工业废水中含有SO42-、Na+、Al3+、Fe3+、Fe2+、Cu2+、Au3+、NH4+等离子,加入过量铁粉过滤得到滤液A为SO42-、Na+、Al3+、NH4+、Fe2+,滤渣G为Fe、Cu、Au,在滤液A中加入过量氢氧化钠溶液过滤得到滤液B为SO42-、Na+、NH3•H2O、NaAlO2,通入过量二氧化碳反应过滤得到沉淀为C为Al(OH)3,反应③为氢氧化铝分解得到氧化铝,D为Al2O3,反应④为电解熔融氧化铝,Q为SO42-、Na+、NH4+、HCO3-,过滤得到E为Fe(OH)2,在空气中防止得到F为氢氧化铁,加热分解发生反应⑥得到氧化铁,反应⑦是铝热反应,铝和氧化铁反应生铁和氧化铝,G中加入过量稀硫酸溶解铁,过滤得到I为Cu和Au,H为硫酸亚铁,I中加入过量稀硝酸溶解铜为硝酸铜,过滤得到金和滤液硝酸铜溶液,加入碱沉淀铜离子,生成氢氧化铜沉淀,反应为氢氧化铜分解生成氧化铜和水,
(1)图中标号处①和⑧需加入的物质分别为NaOH、稀H2SO4,故答案为:NaOH;稀H2SO4 ;
(2)⑤处发生的反应为Fe(OH)2在空气中被氧化为氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,⑦处发生的反应为铝热反应,铝和氧化铁反应生铁和氧化铝,反应的化学方程式为:2Al+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+Al2O3 ,②处发生的反应为过滤二氧化碳和偏铝酸钠溶液反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,⑩处发生的反应为铜和稀硝酸反应生成一氧化氮、硝酸铜和水,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;2Al+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+Al2O3;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)J溶液为过量的硝酸,硝酸铜溶液,加入一定量的Fe、Al粉混合物充分反应后,可能发生的反应依据还原性顺序为Al>Fe>Cu,氧化性HNO3>Cu2+>H+,结合定量关系分析判断可能存在的离子和固体,
a.硝酸过滤可能存在Al3+、Fe3+、Cu2+、无固体,故a正确;
b.当铁部分过量,则溶液中存在Al3+、Fe3+、Fe2+、Cu2+、无固体,故b正确;
c.有铜析出则铁离子一定不存在,Al3+、Fe3+、析出Cu不可能,故c错误;
d.有铁析出一定不含Cu2+,Al3+、Fe2+、Cu2+、析出Fe不可能,故d错误;
e.Al、Fe过量可以析出铜,Al3+、Fe2+、析出Cu,故e正确;
故答案为:a、b、e;
(4)溶液中加入过量的Na2O2固体,与水反应生成NaOH和氧气,放出热量,钠离子增大,Fe2+被氧化成Fe3+,Fe2+减少;
Fe3+、Cu2+、Al3+、NH4+均与碱反应,铝离子转化为偏铝酸根离子,Fe3+转化为氢氧化铁,Cu2+转化为Cu(OH)2,NH4+转化为一水合氨和氨气,故NH4+减少;
再通入过量的稀盐酸,溶液中氢氧化铁转化为铁离子,铁离子增多,偏铝酸根离子转化为铝离子,铝离子、硫酸根离子和铜离子保持不变保持不变,
故答案为:SO42-、Al3+、Cu2+.
点评 本题考查无机物的推断,侧重于物质的分离提纯的考查,解决本题要充分利用题给工艺流程和提供的部分物质,迁移所学的铁三角转化、金属活动性顺序、金属离子的沉淀等知识综合解决,题目难度中等.

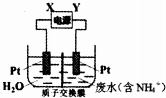
| A. | 直流电源中X为负极 | |
| B. | 阳极反应为2NH4+-6e-=N2↑+8H+ | |
| C. | 阴极反应为2H2O+2e-=H2↑+2OH- | |
| D. | 当有6mol电子转移时,质子交换膜两侧电解质溶液质量变化差为32 g |
| A. | X的原子序数一定为a+2 | |
| B. | Y离子的结构示意图可表示为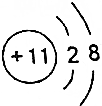 | |
| C. | 若b-a=6.则X和Y形成的化合物一定为离子化合物 | |
| D. | X有可能是非金属元素 |
某同学为测定上述平衡体系中c(I2),采用如下方法:取V1mI平衡混合溶液,用c mol/L的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3═2NaI+Na2S4O6),消耗V2 mL的Na2S2O3溶液.根据V1、V2和c可求得c(I2).下列对该同学设计方案的分析,正确的是( )
| A. | 方案可行.能准确测定溶液中的c(I2) | |
| B. | 方案可行,可采用淀粉做该滴定反应的指示剂 | |
| C. | 不可行.只能测得溶液中c(I2)与c(I3-)之和 | |
| D. | 不可行.因为I-能与Na2S2O3发生反应 |
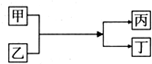
| A. | 若甲为铜,丁为氯化亚铁,则乙一定是氯化铁 | |
| B. | 若甲为水,丁为氢氧化钠,则丙一定是氢气 | |
| C. | 若甲为铝,丁为铁,则乙一定是氧化铁 | |
| D. | 若甲为镁,丁为氢气.则乙一定是酸 |
| A. | pH=3的溶液中:K+、Ba2+、Cl-、Br- | |
| B. | 含有0.1mol•L-1Fe3+的溶液中:K+、Mg2+、I-、SO42- | |
| C. | 含有0.1mol•L-1NO3-的溶液中:Na+、H+、SO42-、Fe2+ | |
| D. | 含有大量AlO2-的溶液中:NH4+、NO3-、Cl-、H+ |
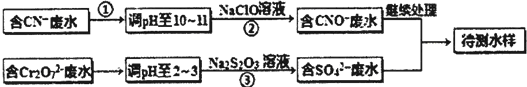
 化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑.请根据你所学知识回答:
化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑.请根据你所学知识回答: