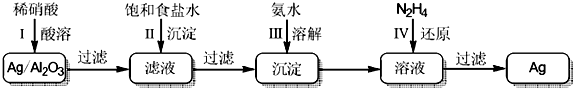
题目内容
14.处于短周期中且相邻周期的X、Y两元素,它们形成的简单离子的电子层相差2层,已知X处于第a主族,Y处于第b主族,b>a,且Y单质中只有共价键,则下列叙述正确的是( )| A. | X的原子序数一定为a+2 | |
| B. | Y离子的结构示意图可表示为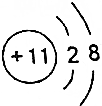 | |
| C. | 若b-a=6.则X和Y形成的化合物一定为离子化合物 | |
| D. | X有可能是非金属元素 |
分析 处于短周期中且相邻周期的X、Y两元素,它们形成的简单离子的电子层相差2层,已知X处于第a主族,Y处于第b主族,b>a,且Y单质中只有共价键,则X为H时,Y为第二周期的N、O、F等;若X为Li或Be,则Y为第三周期的Cl,以此来解答.
解答 解:处于短周期中且相邻周期的X、Y两元素,它们形成的简单离子的电子层相差2层,已知X处于第a主族,Y处于第b主族,b>a,且Y单质中只有共价键,则X为H时,Y为第二周期的N、O、F等;若X为Li或Be,则Y为第三周期的Cl,
A.X为H时,不符合X的原子序数为a+2,故A错误;
B.Y单质中只有共价键,Y不可能为Na,故B错误;
C.若b-a=6,X为H,Y为F,则X和Y形成的化合物HF为共价化合物,故C错误;
D.由上述分析可知,X可能是非金属元素H,故D正确;
故选D.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、原子结构为解答的关键,侧重分析与应用能力的考查,注意相差2个电子层,题目难度不大.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
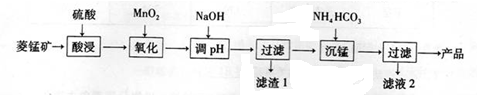
5.辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe2O3、SiO2及一些不溶性杂质.一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如图:
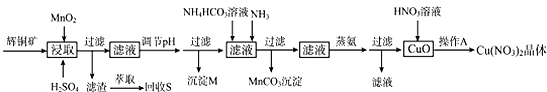
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如表所示(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
回答下列问题
(1)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O.
(2)调节pH的目的是铁离子转化成氢氧化铁完全沉淀,pH的调节范围为3.2≤pH<4.4.
(3)生成MnCO3沉淀的离子方程式为Mn2++NH3+HCO3-=MnCO3↓+NH4+.
(4)操作A为蒸发浓缩、冷却结晶.
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ/mol
2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ/mol
则由Cu2S与O2加热反应生成Cu的热化学方程式为Cu2S(s)+02(g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l.
(6)若用含85% Cu2S(Mr=160)的辉铜矿来制备无水Cu(NO3)2,假设浸取率为95%,调节pH时损Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.6kg这样的辉铜矿最多能制备14.9mol无水Cu(NO3)2.(计算结果精确到小数点后1位)

已知:部分金属阳离子生成氢氧化物沉淀的pH范围如表所示(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O.
(2)调节pH的目的是铁离子转化成氢氧化铁完全沉淀,pH的调节范围为3.2≤pH<4.4.
(3)生成MnCO3沉淀的离子方程式为Mn2++NH3+HCO3-=MnCO3↓+NH4+.
(4)操作A为蒸发浓缩、冷却结晶.
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ/mol
2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ/mol
则由Cu2S与O2加热反应生成Cu的热化学方程式为Cu2S(s)+02(g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l.
(6)若用含85% Cu2S(Mr=160)的辉铜矿来制备无水Cu(NO3)2,假设浸取率为95%,调节pH时损Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.6kg这样的辉铜矿最多能制备14.9mol无水Cu(NO3)2.(计算结果精确到小数点后1位)
2.在一个恒定容积的密闭容器中,发生化学反应2M(g)?N(g)+P(g),若N、P的起始浓度为0,反应物M的浓度随反应时间的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验I中,50min时,N的浓度为0.25mol•L-1,0~50min内,以P的浓度改变表示的反应速率为0.005mol/(L.min).
(2)在实验Ⅱ中,若10~20min内,v(N)=0.10mol•L-1,则c2=0.7mol•L-1.
(3)对比两个实验,推测实验Ⅱ中M的初始浓度c1=1.0mol•L-1,反应经20minM的浓度不再变化,可推测实验Ⅱ中还隐含的条件是实验Ⅱ使用催化剂.
(4)上述实验中,反应达到限度后,M的转化率是50%.
| 实验序号 |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| Ⅰ | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| Ⅱ | 800 | c1 | c2 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
(1)在实验I中,50min时,N的浓度为0.25mol•L-1,0~50min内,以P的浓度改变表示的反应速率为0.005mol/(L.min).
(2)在实验Ⅱ中,若10~20min内,v(N)=0.10mol•L-1,则c2=0.7mol•L-1.
(3)对比两个实验,推测实验Ⅱ中M的初始浓度c1=1.0mol•L-1,反应经20minM的浓度不再变化,可推测实验Ⅱ中还隐含的条件是实验Ⅱ使用催化剂.
(4)上述实验中,反应达到限度后,M的转化率是50%.
9.小明同学对醇、酚部分化学知识整理如下,其中正确的一组是( )
| A | 乙醇反应时断键部位 | B | 基团的相互影响 |
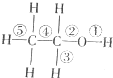 (1)和浓硫酸共热到170℃时②⑤断键 (2)和浓硫酸共热到140℃时只断键② | (1)与钠反应时乙醇比水慢,说明受乙基影响,醇羟基中H原子活泼性减弱 (2)苯酚浊液中加Na0H溶液变澄清,说明受苯环影响,酚羟基中H原子活泼性增强 | ||
| C | 分离提纯 | D | 醇、酚用途 |
| (1)工业乙醇通过蒸馏得无水乙醇 (2)苯中混有苯酚,加溴水沉淀后过滤,除去三溴苯酚沉淀 | (1)甘油加水作护肤剂 (2)酚类化合物有毒,不能用于杀菌消毒 |
| A. | A | B. | B | C. | C | D. | D |
6.化学与社会、生活密切相关,下列说法中正确的是( )
| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 燃料电池中燃料都在负极发生氧化反应 | |
| C. | Fe3O4俗称铁红,常作红色油漆和涂料 | |
| D. | 工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质 |