题目内容
12.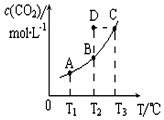 恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )| A. | 在T2时,若反应进行到状态D,则一定有v正<v逆 | |
| B. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| C. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| D. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 |
分析 A.由图可知,曲线上的点为平衡点,T2时,D→B减少二氧化碳的浓度可达到平衡浓度;
B.由图可知,温度越高,二氧化碳的含量越大,则正反应为吸热反应,平衡状态A与C相比,温度不同;
C.温度升高,吸热反应正向移动,K增大;
D.由图可知,温度越高,二氧化碳的含量越大,则正反应为吸热反应.
解答 解:A.由图可知,曲线上的点为平衡点,T2时,D→B减少二氧化碳的浓度可达到平衡浓度,则平衡逆向移动,可知v正<v逆,故A正确;
B.由图可知,温度越高,二氧化碳的含量越大,则正反应为吸热反应,平衡状态A与C相比,温度不同,升高温度正向移动c(CO)减小,则平衡状态C的c(CO)小,故B错误;
C.温度升高,吸热反应正向移动,K增大,可知若T1、T2时的平衡常数分别为K1、K2,则K1<K2,故C正确;
D.由图可知,温度越高,二氧化碳的含量越大,则正反应为吸热反应,即CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,故D正确;
故选B.
点评 本题考查浓度与平衡的曲线,为高频考点,把握图象的意义、温度与浓度关系为解答的关键,侧重分析与应用能力的考查,注意正反应为吸热反应,题目难度不大.

练习册系列答案
相关题目
2.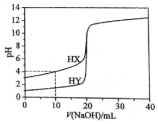 常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )
常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )
 常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )
常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )| A. | V(NaOH)=10.00 mL时,c(X-)>c(Na+)>c(H+)>c(OH-) | |
| B. | V(NaOH)=20.00 mL时,两份溶液中,c(X-)>c(Y-) | |
| C. | V(NaOH)=20.00 mL时,c(Na+)>c(X-)>c(OH-)>c(H+) | |
| D. | pH=7时,两份溶液中,c(X-)=c(Y-) |
3.某化合物通过化合反应生成,向其水溶液中加入足量Na2O2,最终有白色沉淀产生.下列化合物中符合上述条件的是( )
| A. | Ca(HCO3)2 | B. | Na2S | C. | FeI2 | D. | AlCl3 |
7.在四个不同的容器中进行化学反应4A(g)+5B(g)?4C(g)+6D(g),以下是在不同容器中分别用不同物质表示的化学反应速率,所表示反应速率最快的( )
| A. | v (A)=0.36mol•L-1•s-1 | B. | v (B)=0.55mol•L-1•s-1 | ||
| C. | v (C)=0.40mol•L-1•s-1 | D. | v (D)=0.48mol•L-1•s-1 |
17.下列说法正确的是( )
| A. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 | |
| B. | 浓硫酸和浓盐酸长期露置在空气中浓度均降低 | |
| C. | 将CO2气体分别通入BaCl2溶液、Ba(NO3)2溶液中,最终都有沉淀生成 | |
| D. | 用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离 |
4.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,1L 1mol/LHF溶液中含HF分子数目为NA | |
| B. | 2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-a kJ•mol-1,将2mol CO2和6mol H2在一密闭容器中按照上述反应充分反应放出a kJ的热量 | |
| C. | 78gNa2O2固体中含阴离子数目为NA | |
| D. | 25g质量分数68%的H2O2水溶液中含氧原子数目为NA |
1.化学与科学、技术、社会和环境密切相关.下列有关说法中错误的是( )
| A. | 同温同压下,反应H2(g)+Cl2(g)﹦2HCl(g) 在光照和点燃条件的△H相同 | |
| B. | 常温下,反应 C(s)+CO2(g)﹦2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | △H<0、△S>0的反应在任何条件下都能自发进行 | |
| D. | 反应N2(g)+3H2(g)?2NH3(g),加入催化剂能加快反应速率并提高转化率 |
15.1mol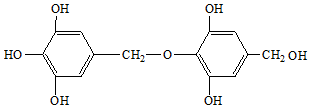 与足量的溴水共热,充分反应后,最多可消耗溴的物质的量是( )
与足量的溴水共热,充分反应后,最多可消耗溴的物质的量是( )
 与足量的溴水共热,充分反应后,最多可消耗溴的物质的量是( )
与足量的溴水共热,充分反应后,最多可消耗溴的物质的量是( )| A. | 3 mol | B. | 4 mol | C. | 5 mol | D. | 2 mol |