题目内容
17.下列说法正确的是( )| A. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 | |
| B. | 浓硫酸和浓盐酸长期露置在空气中浓度均降低 | |
| C. | 将CO2气体分别通入BaCl2溶液、Ba(NO3)2溶液中,最终都有沉淀生成 | |
| D. | 用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离 |
分析 A.三价铁离子氧化性强于铜离子,铁先与三价铁离子反应;
B.依据浓硫酸的吸水性,浓盐酸的挥发性解答;
C.碳酸酸性弱于硝酸、盐酸,依据强酸制备弱酸规律解答;
D.NH4Cl固体和Ca(OH)2固体加热反应生成氯化钙、氨气和水.
解答 解:A.将铁粉加入FeCl3、CuCl2混合溶液中,如果铁粉少量,充分反应后剩余的固体中可以只有铜,故A错误;
B.浓硫酸的吸水性,能够吸收空气中的水而使浓度降低,浓盐酸的挥发性,氯化氢挥发,盐酸浓度降低,故B正确;
C.碳酸酸性弱于硝酸、盐酸,依据强酸制备弱酸规律,二氧化碳气体分别通入BaCl2溶液、Ba(NO3)2溶液中,不发生反应,故C错误;
D.NH4Cl固体和Ca(OH)2固体加热反应生成氯化钙、氨气和水,不能将二者分离,故D错误;
故选:B.
点评 本题考查了元素化合物性质,熟悉铁、浓硫酸的性质是解题关键,侧重考查学生对基础知识掌握熟练程度,题目难度不大.

练习册系列答案
相关题目
5.若mg氢气中含n个氢原子,则阿伏加德罗常数可表示为( )
| A. | 2nmol-1 | B. | $\frac{n}{m}$mol-1 | C. | $\frac{2n}{m}$mol-1 | D. | nmol-1 |
12.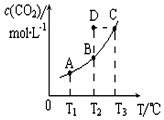 恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
 恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )| A. | 在T2时,若反应进行到状态D,则一定有v正<v逆 | |
| B. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| C. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| D. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 |
9.室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A. | 溶液中导电粒子的数目减少 | |
| B. | 再加入10mL pH=11的NaOH溶液,混合液pH=7 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)c(O{H^-})}}$不变 |
20.元素X的原子,其M层与K层电子数相同;元素Y的原子,其L层上有5个电子.X和Y所形成的稳定化合物的摩尔质量为( )
| A. | 148g•mol-1 | B. | 100g•mol-1 | C. | 90g•mol-1 | D. | 38g•mol-1 |
 T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.
T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.