题目内容
6.已知某温度下的热化学方程式:2SO2(g)+O2(g)?2SO3(g);△H=-197KJ/mol,在恒温时,向恒容密闭容器中通入2molSO2和1molO2,达平衡时放出热量Q1KJ,向另一容积相同的恒容密闭容器中通入1.5molSO2,0.75molO2和0.5molSO3,达平衡时放出热量Q2KJ.下列关系正确的是( )| A. | Q1=Q2=197 | B. | Q1=Q2<197 | C. | Q1<Q2<197 | D. | Q2<Q1<197 |
分析 2SO2(g)+O2(g)?2SO3(g),△H=-197kJ/mol,该反应是放热反应,方程式表示2molSO2和1molO2完全反应,生成2molSO3时,放热197kJ,考虑到可逆反应,不可能完全反应进行到底,最终达到化学平衡这一点来解答.
解答 解:反应的热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol
由热化学方程式可知,在同温同压条件下,2molSO3和1molO2完全反应生成2molSO3时,反应放热197kJ,事实上,反应不会进行到底,最终反应产物的物质的量必然小于2molSO3,因此,Q1<197.
通入1.5molSO2,0.75molO2,0.5molSO3,这个条件其实可以看成是由2molSO3和1molO2开始反应到达1.5molSO2,0.75molO2,0.5molSO3这个状态,两种反应条件是互为等效平衡的,到达平衡时各组分物质的量一样,相比第一个反应到达平衡时,此反应少反应了一部分,放出热量必然相对于第一个反应要少,综上,则有Q2<Q1<197.
故选D.
点评 本题考察反应热的计算,题目难度中等,注意等效平衡法的应用带来的解题的方便.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
3.在一定体积的密闭容器中,进行化学反应:CO2(g)+H2(g)?CO(g)+H2O(g)达到平衡状态,其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$;再充入CO2气体,则平衡正向移动(选“正向移动”、“逆向移动”或“不移动”),平衡常数K不变(选“增大”、“减小”或“不变”).
(2)该反应的逆反应方向为放热反应方向(选填吸热、放热).
(3)能判断该反应是否达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下的各物质平衡浓度符合:c(CO2)=c(CO),c(H2)=c(H2O),试判断此时的温度为830℃.
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$;再充入CO2气体,则平衡正向移动(选“正向移动”、“逆向移动”或“不移动”),平衡常数K不变(选“增大”、“减小”或“不变”).
(2)该反应的逆反应方向为放热反应方向(选填吸热、放热).
(3)能判断该反应是否达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下的各物质平衡浓度符合:c(CO2)=c(CO),c(H2)=c(H2O),试判断此时的温度为830℃.
11. 铁有δ、γ、α三种晶体结构,以下依次是δ、γ、α三种晶体不同温度下转化的图示,下列有关说法不正确的是( )
铁有δ、γ、α三种晶体结构,以下依次是δ、γ、α三种晶体不同温度下转化的图示,下列有关说法不正确的是( )
 铁有δ、γ、α三种晶体结构,以下依次是δ、γ、α三种晶体不同温度下转化的图示,下列有关说法不正确的是( )
铁有δ、γ、α三种晶体结构,以下依次是δ、γ、α三种晶体不同温度下转化的图示,下列有关说法不正确的是( )| A. | δ-Fe晶体中与相邻铁原子距离相等且最近的铁原子有8个 | |
| B. | γ-Fe晶体中与相邻铁原子距离相等且最近的铁原子有12个 | |
| C. | α-Fe晶胞边长若为a cm,y-Fe晶胞边长若为b cm,则a-Fe和y-Fe两种晶体的 密度比为b3:a3 | |
| D. | 将铁加热到1500℃后分别急速冷却和缓慢冷却,得到的晶体类型不同 |
18.下列有关物质制备及应用的说法不正确的是( )
| A. | 很早以前人们用加热胆矾或绿矾的方法制取硫酸 | |
| B. | 将氢气在氯气中燃烧生成氯化氢,然后溶于水得到盐酸,工业上常用此法制取盐酸 | |
| C. | 苏打是焙制糕点所用的发酵粉的主要成分之一,还可以用来治疗胃酸过多的一种药剂 | |
| D. | “水玻璃”是建筑行业中经常使用的一种黏合剂,同时也可用作防腐剂和防火剂 |

 b.
b.
 d.
d.
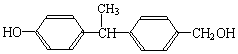
 结构相似的醇不能被氧化为醛或酸.
结构相似的醇不能被氧化为醛或酸.
 .
.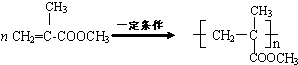 .
. (称为羟醛缩合反应)
(称为羟醛缩合反应)
 .
. .
. ;
; .
.