题目内容
20.邻苯二甲酸二丁酯(DBP)是一种常见的塑化剂,可由乙烯和邻二甲苯合成.已知:
 (称为羟醛缩合反应)
(称为羟醛缩合反应)DBP的合成过程如下:

(1)A中含有的官能团名称是醛基.
(2)写出反应类型:反应③消去反应;反应⑤取代反应.
(3)F的结构简式为
 .
.(4)化合物B有多种同分异构体,其中只含有一种官能团的同分异构体有6种;如果这种同分异构体能与NaHCO3溶液反应生成气体,在核磁共振氢谱中只有3处吸收峰,写出其结构简式
 .
.(5)写出反应⑧、⑩的化学方程式
⑧
 ;
;⑩
 .
.
分析 A发生信息中醛的加成反应生成B,则A为CH3CHO,B为 ,故乙烯发生氧化反应生成乙醛.B脱去1分子水生成C,结合分子式可知发生消去反应,故C为CH3CH=CHCHO或CH2=CHCH2CHO,C与氢气发生加成反应生成D,由C、D分子式可知,碳碳双键、醛基均发生加成反应,故D为CH3CH2CH2CH2OH,E与D发生酯化反应生成DBP为
,故乙烯发生氧化反应生成乙醛.B脱去1分子水生成C,结合分子式可知发生消去反应,故C为CH3CH=CHCHO或CH2=CHCH2CHO,C与氢气发生加成反应生成D,由C、D分子式可知,碳碳双键、醛基均发生加成反应,故D为CH3CH2CH2CH2OH,E与D发生酯化反应生成DBP为 ,逆推M为
,逆推M为 ,H为
,H为 ,G为
,G为 ,F为
,F为 ,E为
,E为 ,以此解答该题.
,以此解答该题.
解答 解:(1)A为CH3CHO,含有的官能团为醛基,故答案为:醛基;
(2)反应③是 发生消去反应生成CH3CH=CHCHO或CH2=CHCH2CHO,
发生消去反应生成CH3CH=CHCHO或CH2=CHCH2CHO,
反应⑤是邻二甲苯发生取代反应生成 ,
,
故答案为:消去反应; 取代反应;
(3)由上述分析可知,F的结构简式为 ,故答案为:
,故答案为: ;
;
(4)B为 ,有多种同分异构体,其中只含有一种官能团,可能为羧基或酯基,如含羧基,则为丁酸,同分异构体数目取决于-C3H7,有2种,如含有酯基,则可为乙酸乙酯、丙酸甲酯、甲酸丙酯(甲酸异丙酯),共6种,同分异构体能与NaHCO3溶液反应生成气体,说明含有-COOH,在核磁共振氢谱中只有3处吸收峰,其结构简式为
,有多种同分异构体,其中只含有一种官能团,可能为羧基或酯基,如含羧基,则为丁酸,同分异构体数目取决于-C3H7,有2种,如含有酯基,则可为乙酸乙酯、丙酸甲酯、甲酸丙酯(甲酸异丙酯),共6种,同分异构体能与NaHCO3溶液反应生成气体,说明含有-COOH,在核磁共振氢谱中只有3处吸收峰,其结构简式为 ,
,
故答案为:6; ;
;
(5)反应⑧的化学方程式为: ,
,
反应⑩的化学方程式为: ,
,
故答案为: ;
; .
.
点评 本题考查有机物的推断,为高考常见题型,注意根据有机物分子式、反应条件以及题目给予的反应信息进行推断,熟练有机物官能团性质与转化是关键,侧重考查学生分析推理能力,题目难度中等.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
12.下表是3种物质的溶解度(20℃),下列说法正确的是( )
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.00084 | 0.01 |
| A. | 已知MgCO3的Ksp=6.82×l0-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6 | |
| B. | 用石灰水处理含有Mg2+和HCO3-的硬水,发生反应的离子方程式:Mg2++2HCO3-+2Ca2++4OH-═2CaCO3↓+Mg(OH)2↓+2H2O | |
| C. | 将表中3种物质与水混合,加热蒸干、灼烧,最终的固体产物不相同 | |
| D. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 |
8.氮的固定是几百年来科学家一直研究的课题.
(1)表列举了不同温度下大气固氮和工业固氮的部分K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р1<р1.(填“<”、“>”或者“=”)

(1)表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2 (g)+O2 (g)?2NO(g) | 工业固氮 N2 (g)+3H2 (g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р1<р1.(填“<”、“>”或者“=”)

15.(1)基态Cl原子中,电子占据的最高能层符号为M.
(2)金属锂氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
M是Mg (填元素符号).
(3)金属Cu的原子堆积模型为;Cu2+基态的电子排布式为1s22s22p63s23p63d9;向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4•H2O晶体,硫酸根离子中硫原子的杂化方式为sp3;不考虑空间构型,其内界结构可用示意图表示为 .
.
(4)某单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示,若已知该原子半径为d,NA表示阿伏伽德罗常数.摩尔质量为M,则该原子的配位数为12,该晶体的密度可表示为$\frac{{M}_{r}}{4\sqrt{2}{d}^{3}{N}_{A}}$.

(2)金属锂氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)金属Cu的原子堆积模型为;Cu2+基态的电子排布式为1s22s22p63s23p63d9;向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4•H2O晶体,硫酸根离子中硫原子的杂化方式为sp3;不考虑空间构型,其内界结构可用示意图表示为
 .
.(4)某单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示,若已知该原子半径为d,NA表示阿伏伽德罗常数.摩尔质量为M,则该原子的配位数为12,该晶体的密度可表示为$\frac{{M}_{r}}{4\sqrt{2}{d}^{3}{N}_{A}}$.

6.已知某温度下的热化学方程式:2SO2(g)+O2(g)?2SO3(g);△H=-197KJ/mol,在恒温时,向恒容密闭容器中通入2molSO2和1molO2,达平衡时放出热量Q1KJ,向另一容积相同的恒容密闭容器中通入1.5molSO2,0.75molO2和0.5molSO3,达平衡时放出热量Q2KJ.下列关系正确的是( )
| A. | Q1=Q2=197 | B. | Q1=Q2<197 | C. | Q1<Q2<197 | D. | Q2<Q1<197 |
3.下列有关实验正确的是( )
| A. | 制取溴苯:将铁屑、溴水、苯混合加热 | |
| B. | 等物质的量的甲烷和乙酸完全燃烧消耗氧气的量相等 | |
| C. | 把溴水分别加到足量NaOH溶液和己烯中,充分反应后溶液都呈无色,所以不能用溴水鉴别这两种物质 | |
| D. | 检验某溶液中是否含有乙醛:在盛有2 mL 10%CuSO4溶液的试管中滴加0.5mL10%NaOH溶液,混合均匀,滴入待检液,加热,看是否产生砖红色沉淀 |
4.下列表示正确的是( )
| A. | 氯化氢的电子式: | |
| B. | 质子数为6,中子数为8的核素:${\;}_{6}^{14}$C | |
| C. | Na+的结构示意图: | |
| D. | CH4分子的球棍模型: |
 将1mol I2(g) 和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
将1mol I2(g) 和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示: +H2O
+H2O
 ;E中含氧官能团的名称:羧基.
;E中含氧官能团的名称:羧基. +
+ $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.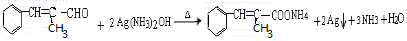 .
. .
.