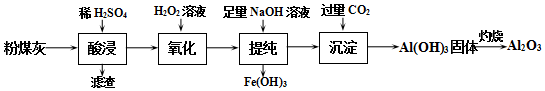
题目内容
15.已知33As、34Se、35Br位于同一周期,下列关系正确的是( )| A. | 电负性:As>Cl>P | B. | 热稳定性:HCl>HBr>AsH3 | ||
| C. | 第一电离能:Br>Se>As | D. | 酸性:H3AsO4>H2SO4>H3PO4 |
分析 A.非金属性越强,电负性越大;
B.元素的非金属性越强,其气氢化物的热稳定性越强;
C、As处于VA,外围电子处于半满的较稳定结构,故As的第一电离能大于Se;
D、非金属性越强,最高价氧化物的水化物酸性越强.
解答 解:A.非金属性为Cl>P>As,则电负性为Cl>P>As,故A错误;
B.元素的非金属性越强,其气氢化物的热稳定性越强,非金属性:Cl>Br>As,所以稳定性HCl>HBr>AsH3,故B正确;
C.As处于VA,外围电子处于半满的较稳定结构,故As的第一电离能大于Se,所以第一电离能:Br>Se>As,故C错误;
D、非金属性S>P>As,最高价氧化物的水化物酸性为H2SO4>H3PO4>H3AsO4,故D错误;
故选B.
点评 本题考查非金属性的性质,为高频考点,把握元素的位置、性质及元素周期律等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
20.与钢相比,生铁的含碳量( )
| A. | 较多 | B. | 较少 | C. | 一样多 | D. | 不能确定 |
10.下列关于胶体的说法中,正确的是( )
| A. | 胶体一定是均一、透明、介稳的 | B. | 用丁达尔效应区别胶体和溶液 | ||
| C. | 可以用滤纸来分离胶体和溶液 | D. | 胶体只能在液体中形成 |
7. 在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,含有手性碳原子的有机物具有光学活性,下边有机物含有一个手性碳原子(*C表示手性碳原子),具有光学活性.若要消除其光学活性,可选用下列哪些化学反应( )
在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,含有手性碳原子的有机物具有光学活性,下边有机物含有一个手性碳原子(*C表示手性碳原子),具有光学活性.若要消除其光学活性,可选用下列哪些化学反应( )
①加成②氧化③加聚④酯化⑤水解⑥消去⑦缩聚.
 在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,含有手性碳原子的有机物具有光学活性,下边有机物含有一个手性碳原子(*C表示手性碳原子),具有光学活性.若要消除其光学活性,可选用下列哪些化学反应( )
在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,含有手性碳原子的有机物具有光学活性,下边有机物含有一个手性碳原子(*C表示手性碳原子),具有光学活性.若要消除其光学活性,可选用下列哪些化学反应( )①加成②氧化③加聚④酯化⑤水解⑥消去⑦缩聚.
| A. | 只有①②③ | B. | 只有④⑤⑥ | C. | 只有①②④⑤⑥ | D. | 以上都可以 |
4.在体积不变的绝热密闭容器中,一定量SO2与1molO2在催化剂作用下发生反应:2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g)△H=-QkJ/mol(Q>0).当气体的物质的量减少0.5mol时反应达到平衡.下列叙述正确的是( )
| A. | 再通入1molO2,平衡正向移动,平衡常数不变 | |
| B. | 降低温度,正反应速率先减小后增大 | |
| C. | 平衡时SO2气体的转化率为50% | |
| D. | 该条件下反应放出0.5QkJ的热量 |
5.下列变化中,必须加入氧化剂才能发生的是( )
| A. | Na→Na2O2 | B. | SO2→S | C. | NaHCO3→CO2 | D. | HCl→H2 |
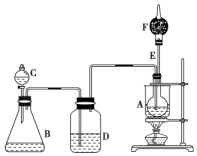 已知CH3CH2OH+NaBr+H2SO4CH3CH2Br+NaHSO4+H2O,如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.
已知CH3CH2OH+NaBr+H2SO4CH3CH2Br+NaHSO4+H2O,如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.