题目内容
10.钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域.(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性.
①该催化剂中铁元素的化合价为+3.
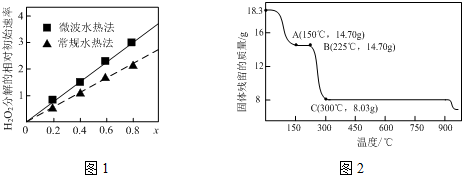
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线.由图中信息可知:微波水热法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是Co2+.
(2)草酸钴是制备钴的氧化物的重要原料.下图2为二水合草酸钴(CoC2O4•2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物.
①通过计算确定C点剩余固体的化学成分为Co3O4(填化学式).试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式:3CoC2O4+2O2$\frac{\underline{\;\;△\;\;}}{\;}$Co3O4+6CO2.
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480mL 5mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48L(标准状况)黄绿色气体.试确定该钴氧化物中Co、O的物质的量之比.
分析 (1)①根据化合价代数和为0计算Fe的化合价;
②过氧化氢的分解速率越大,催化剂活性更高;随x值越大,过氧化氢的分解速率越大,而x增大,Co2+的比例增大;
(2)①由图可知,CoC2O4•2H2O的质量为18.3g,其我知道可为0.1mol,Co元素质量为5.9g,C点钴氧化物质量为8.03g,氧化物中氧元素质量为8.03g-5.9g=2.13g,则氧化物中Co原子与O原子物质的量之比为0.1mol:$\frac{2.13g}{16g/mol}$≈3:4,故C的Co氧化物为Co3O4;
B点对应物质的质量为14.7g,与其起始物质的质量相比减少18.3g-14.7g=3.6g,为结晶水的质量,故B点物质为CoC2O4,与氧气反应生成Co3O4与二氧化碳;
②由电子守恒:n(Co3+)=2 n(Cl2),由电荷守恒:n(Co原子)总=n(Co2+)溶液=$\frac{1}{2}$n(Cl-),联立计算n氧化物(Co2+),根据化合价电荷守恒为0计算氧化物中n(O),进而计算氧化物中n(Co):n(O).
解答 解:(1)①CoxNi(1-x)Fe2O4中Co、Ni均为+2,O为-2价,则Fe的化合价为$\frac{4×2-(2x+2-2x)}{2}$=+3,
故答案为:+3;
②过氧化氢的分解速率越大,催化剂活性更高,根据图象可知,x相同时,微波水热法初始速度大于常规水热法,故微波水热法制得催化剂的活性更高;
由图可知,随x值越大,过氧化氢的分解速率越大,而x增大,Co2+的比例增大,故Co2+的催化活性更高,
故答案为:微波水热;Co2+;
(2)①由图可知,CoC2O4•2H2O的质量为18.3g,其我知道可为0.1mol,Co元素质量为5.9g,C点钴氧化物质量为8.03g,氧化物中氧元素质量为8.03g-5.9g=2.13g,则氧化物中Co原子与O原子物质的量之比为0.1mol:$\frac{2.13g}{16g/mol}$≈3:4,故C的Co氧化物为Co3O4;
B点对应物质的质量为14.7g,与其起始物质的质量相比减少18.3g-14.7g=3.6g,为结晶水的质量,故B点物质为CoC2O4,与氧气反应生成Co3O4与二氧化碳,反应方程式为:3CoC2O4+2O2$\frac{\underline{\;\;△\;\;}}{\;}$Co3O4+6CO2,
故答案为:Co3O4;3CoC2O4+2O2$\frac{\underline{\;\;△\;\;}}{\;}$Co3O4+6CO2;
②由电子守恒:n(Co3+)=2 n(Cl2)=2×$\frac{4.48L}{22.4L/mol}$=0.4 mol,
由电荷守恒:n(Co原子)总=n(Co2+)溶液=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×( 0.48L×5mol/L-2×$\frac{4.48L}{22.4L/mol}$)=1 mol,所以固体中的n(Co2+)=1mol-0.4mol=0.6 mol,
根据化合价电荷守恒为0,氧化物中n(O)=(0.6mol×2+0.4mol×3)÷2=1.2mol,
故该钴氧化物中n(Co):n(O)=1mol:1.2mol=5:6,
答:该钴氧化物中Co、O的物质的量之比为5:6.
点评 本题考查元素化合价的判断、物质化学式的计算、得失电子守恒规律的应用、对图象的分析处理等,需要学生具备知识的基础,难度中等.

 全优点练单元计划系列答案
全优点练单元计划系列答案| A. | HF的电子式为: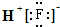 | B. | HClO的结构式:H-Cl-O | ||
| C. | CO2的电子式为: | D. | Cl-的结构示意图: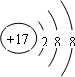 |
| A. | 溶液中c(OH-)减小 | B. | pH的变化值小于2 | ||
| C. | 溶液中H+的数目增大 | D. | Kw的值减小 |
 有机物X由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线表示单键或双键).关于该有机物叙述正确的是( )
有机物X由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线表示单键或双键).关于该有机物叙述正确的是( )| A. | 分子中含有3种官能团 | |
| B. | 1 mol该有机物与足量溴水反应最多消耗3molBr2 | |
| C. | 1 mol该有机物最多能与2 mol NaOH反应 | |
| D. | 该有机物若能使酸性KMnO4溶液褪色,则可证明其分子中存在碳碳双键 |
 NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:
NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:Ⅰ.利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO(g)+2CO(g) $\stackrel{催化剂}{?}$ 2CO2(g)+N2(g)△H=-748kJ/mol
为了测定某催化剂作用下的反应速率,在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生上述反应.用气体传感器测得不同时间NO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
(2)达到平衡时,下列措施能提高NO转化率的是BD.(填字母序号)
A.选用更有效的催化剂B.降低反应体系的温度
C.充入氩气使容器内压强增大D.充入CO使容器内压强增大
(3)已知N2(g)+O2(g)=2NO(g)△H=+180kJ/mol;则CO的燃烧热为284kJ/mol.
Ⅱ.臭氧也可用于处理NO.
(4)O3氧化NO结合水洗可产生HNO3和O2,每生成1mol的HNO3转移3mol电子.
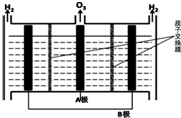
(5)O3可由电解稀硫酸制得,原理如图.图中阴极为B(填“A”或“B”),阳极(惰性电极)的电极反应式为3H2O-6e-=O3+6H+.
| 事实 | 推测 | |
| A | Mg与水反应缓慢,Ca与水反应较快 | Be与水反应会更快 |
| B | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| C | SiH4,PH3在空气中能自燃 | H2S在空气中也能自燃 |
| D | 标况下HCl,HBr均为气体 | HF也为气体 |
| A. | A | B. | B | C. | C | D. | D |
 氮及其化合物在生产、生活中有着重要作用.
氮及其化合物在生产、生活中有着重要作用.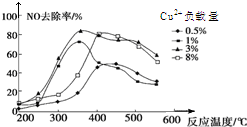 雾霾严重影响人们的生活,汽车尾气的排放是造成雾霾天气的重要原因之一.已知汽车尾气排放时容易发生以下反应:
雾霾严重影响人们的生活,汽车尾气的排放是造成雾霾天气的重要原因之一.已知汽车尾气排放时容易发生以下反应:
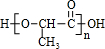 .
.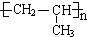 ,该反应类型是加聚反应.
,该反应类型是加聚反应.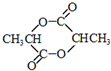 .
.