题目内容
3.根据能量变化示意图,下列说法正确的是( )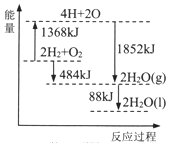
| A. | 拆开2molH2(g)和1 molO2(g)中的化学键,共放出1368 kJ能量 | |
| B. | 1 molH2和0.5molO2的能量之和比1 molH2O(1)的能量大242 kJ | |
| C. | 2H2O(g)=2H2(g)+O2(g)△H=+484KJ/mol | |
| D. | 2H2(g)+O2(g)=2H2O(1)△H=572KJ/mol |
分析 A.断裂化学键吸收能量;
B.由图可知,1 molH2和0.5molO2的能量之和比1 molH2O(g)的能量大242 kJ;
C.由图可知,2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol,互为逆反应时,焓变数值相同、符号相反;
D.燃烧为放热反应,由图可知生成2molH2O(1)放热为484kJ+88kJ=572kJ.
解答 解:A.拆开2molH2(g)和1 molO2(g)中的化学键,共吸收1368 kJ能量,故A错误;
B.由图可知,1 molH2和0.5molO2的能量之和比1 molH2O(g)的能量大242 kJ,生成液态水时放出热量更多,故B错误;
C.由图可知,2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol,则2H2O(g)=2H2(g)+O2(g)△H=+484KJ/mol,故C正确;
D.燃烧为放热反应,由图可知生成2molH2O(1)放热为484kJ+88kJ=572kJ,则2H2(g)+O2(g)=2H2O(1)△H=-572KJ/mol,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握图中能量变化与反应的关系、物质的量与热量成正比为解答的关键,侧重分析与应用能力的考查,注意焓变的正负,题目难度不大.

练习册系列答案
相关题目
6.下列化学反应的离子方程式,书写不正确的是( )
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 向氯化铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 氯化亚铁溶液中通入少量氯气:Cl2+2Fe2+═2Fe3++2Cl- | |
| D. | 往明矾溶液中滴加Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++2SO42-+Al3++4OH-═2BaSO4↓+AlO2-+2H2O |
11.某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX中所含质子的物质的量是( )
| A. | $\frac{a}{m+A}$(A-N+m)mol | B. | a/N(A-N)mol | C. | a/A(A-N+m)mol | D. | a/A(A-N-m)mol |
18.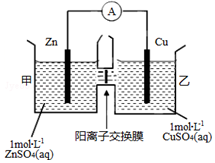 锌铜原电池装置如图所示,中间被阳离子交换膜隔开且只允许阳离子和水分子通过,下列有关叙述正确的是( )
锌铜原电池装置如图所示,中间被阳离子交换膜隔开且只允许阳离子和水分子通过,下列有关叙述正确的是( )
 锌铜原电池装置如图所示,中间被阳离子交换膜隔开且只允许阳离子和水分子通过,下列有关叙述正确的是( )
锌铜原电池装置如图所示,中间被阳离子交换膜隔开且只允许阳离子和水分子通过,下列有关叙述正确的是( )| A. | 铜电极上发生氧化反应 | |
| B. | 外电路中电子由Cu流向Zn | |
| C. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| D. | 电池工作一段时间后,甲池的C(SO42-)增大 |
8.下列说法错误的是( )
| A. | 酸雨形成的主要原因是大量石油、煤等矿物燃料的燃烧 | |
| B. | 反应物的总能量高于生成物的总能量时,反应放热 | |
| C. | 原电池是化学能转变为电能的一种装置 | |
| D. | 在铜、锌和稀硫酸构成的原电池中,铜是负极 |
15.下列物质的水溶液能导电,但属于非电解质的是( )
| A. | CH3CH2COOH | B. | Cl2 | C. | NH4HCO3 | D. | SO2 |
12.酸雨的形成主要原因是( )
| A. | 森林乱砍乱伐 | B. | 工业上大量使用含硫燃料 | ||
| C. | 大气中二氧化碳含量增多 | D. | 汽车排放出大量尾气 |
13.下列有关实验装置及实验方案的设计不正确的是( )
| 选项 | A | B | C | D |
| 实验装置 |  |  |  |  |
| 实验设计 | 探究SO2的氧化性和漂白性 | 实验室制氨气并收集干燥的氨气 | 验证苯中是否有碳碳双键 | 用乙醇提取溴水中的Br2 |
| A. | A | B. | B | C. | C | D. | D |