题目内容
13.下列有关实验装置及实验方案的设计不正确的是( )| 选项 | A | B | C | D |
| 实验装置 |  |  |  |  |
| 实验设计 | 探究SO2的氧化性和漂白性 | 实验室制氨气并收集干燥的氨气 | 验证苯中是否有碳碳双键 | 用乙醇提取溴水中的Br2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫能够漂白品红溶液,与硫化氢反应生成S单质证明二氧化硫具有氧化性;
B.氨气为碱性气体,可以碱石灰干燥,氨气极易溶于水,可以形成喷泉;
C.苯不与溴和酸性高锰酸钾溶液反应,证明苯分子中不存在碳碳双键;
D.乙醇与水互溶,萃取溴水中的溴不能用乙醇作萃取剂.
解答 解:A.通过SO2使品红溶液褪色可证明SO2具有漂白性,通过SO2与硫化氢的反应可以证明SO2具有氧化性,能够达到实验目的,故A不选;
B.加热氢氧化钙与氯化铵可以获得氨气,氨气为碱性气体,可以用碱石灰干燥;氨气极易溶于水,可以误差喷泉实验,图示装置能够达到实验目的,故B不选;
C.苯不能与溴发生加成反应,也不能被酸性高锰酸钾溶液氧化,可验证苯中没有碳碳双键,能够达到实验目的,故C不选;
D.乙醇与水互溶,混合液不分层,无法用乙醇提取溴水中的Br2,可以用苯或四氯化碳作萃取剂,故D选;
故选D.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及二氧化硫性质、氨气制取及干燥、苯的结构与性质、萃取等知识,明确常见元素及其化合物性质为解答关键,试题有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.根据能量变化示意图,下列说法正确的是( )
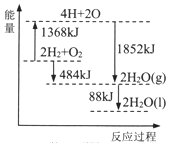

| A. | 拆开2molH2(g)和1 molO2(g)中的化学键,共放出1368 kJ能量 | |
| B. | 1 molH2和0.5molO2的能量之和比1 molH2O(1)的能量大242 kJ | |
| C. | 2H2O(g)=2H2(g)+O2(g)△H=+484KJ/mol | |
| D. | 2H2(g)+O2(g)=2H2O(1)△H=572KJ/mol |
1.下列说法正确的是( )
| A. | 3C(s)+CaO(s)═CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| B. | 0.1mol/L氨水加水稀释后,溶液中$\frac{c(O{H}^{-})}{c(N{{H}_{3}•{H}_{2}O}_{\;})}$的值减小 | |
| C. | 常温常压下,22.4L Cl2中含有的分子数为6.02×1023个 | |
| D. | 合成氨时,其他条件不变,升高温度,氢气的反应速率和平衡转化率均增大 |
8.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 足量Mg与2.8gN2完全反应后失去0.2NA电子 | |
| B. | 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA | |
| C. | 常温常压下,2.8gC2H4含有共用电子对的数目为0.6NA | |
| D. | 16gO2含有NA个18O原子 |
18.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 9 g超重水(3H216O)含中子数为6NA | |
| B. | 标准状况下,22.4 L CCl4含有的分子数目为NA | |
| C. | 常温常压下,16g甲烷中共价键数目为4NA | |
| D. | 1 L 0.1 mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1 NA |
5.短周期元素X、Y、Z、W的原子序数依次增大.它们的原子最外层电子数之和为13,X的原子半径比Y的小,其中X与W同主族.一种常见的无色无味液体分解可以得到X和Z元素的单质.下列说法中不正确的是( )
| A. | X、Y、Z三种元素可以形成离子化合物 | |
| B. | 元素X 和W之间不可能形成二元化合物 | |
| C. | 元素Y的简单气态氧化物的热稳定性比Z的弱 | |
| D. | 元素Y、Z、W中,元素W的简单离子的半径最小 |
2.以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如图.下列说法正确的是( )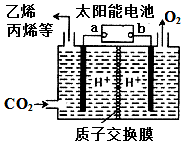

| A. | a电极为太阳能电池的正极 | |
| B. | 产生丙烯的电极反应式为:3CO2+18H++18e-═CH3CH=CH2+6H2O | |
| C. | 装置中每转移2e-,理论上有2molH+通过质子交换膜从左向右扩散 | |
| D. | 太阳能电池的原理与原电池的原理相同 |
14.检验制得的HCl气体中混有少量Cl2的方法是( )
| A. | 观察气体的颜色 | B. | 用干燥的蓝色石蕊试纸 | ||
| C. | 用硝酸银溶液 | D. | 用湿润的淀粉碘化钾试纸 |