题目内容
11.某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX中所含质子的物质的量是( )| A. | $\frac{a}{m+A}$(A-N+m)mol | B. | a/N(A-N)mol | C. | a/A(A-N+m)mol | D. | a/A(A-N-m)mol |
分析 根据质子数=质量数-中子数计算X原子质子数,进而计算每个HmX分子含有质子数,根据n=$\frac{m}{M}$计算HmX的物质的量,结合每个分子含有质子数计算.
解答 解:某元素的一种同位素X的原子质量数为A,含N个中子,则质子数为(A-N),则每个HmX分子含有质子数为(A-N+m),ag HmX的物质的量为$\frac{ag}{(m+A)g/mol}$=$\frac{a}{m+A}$mol,故含有质子物质的量为$\frac{a}{m+A}$mol×(A-N+m)=$\frac{a}{m+A}$(A-N+m) mol,故选A.
点评 本题考查物质的量有关计算、原子结构,比较基础,属于字母型计算,一定程度上增大计算难度.

练习册系列答案
相关题目
14.为了检验SO2的性质,下列实验现象、解释与结论均正确的是( )
| 编号 | 实验操作 | 实验现象 | 解释与结论 |
| A | 将SO2气体通入KMnO4(H+)溶液中 | 溶液褪色 | SO2有漂白性 |
| B | 将SO2气体通入H2S溶液中 | 溶液变浑浊 | SO2有氧化性 |
| C | 将SO2气体通入紫色石蕊溶液中 | 溶液先变红色后褪色 | SO2是酸性氧化物 |
| D | 将SO2气体通入Ca(ClO)2溶液中 | 溶液变浑浊 | 亚硫酸的酸性比次氯酸的酸性强 |
| A. | A | B. | B | C. | C | D. | D |
2.配制200mL 0.100mol•L-1盐酸溶液时,下列实验操作使所配的溶液浓度偏大的是( )
| A. | 用量筒量取所需的浓盐酸时仰视读数 | |
| B. | 用量筒量取的浓盐酸时,量筒里有少许蒸馏水 | |
| C. | 定容时,仰视标线 | |
| D. | 定容后倒转容量瓶数次摇匀,发现液面最低点低于标线,再补加几滴蒸馏水至标线 |
19.已知(1)H2O(g)=H2O(l)△H1=-Q1 kJ•mol-1
(2)CH3OH(g)=CH3OH(l)△H2=-Q2 kJ•mol-1
(3)2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H3=-Q3 kJ•mol-1
(Q1、Q2、Q3均大于0)若使1mol液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)( )
(2)CH3OH(g)=CH3OH(l)△H2=-Q2 kJ•mol-1
(3)2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H3=-Q3 kJ•mol-1
(Q1、Q2、Q3均大于0)若使1mol液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)( )
| A. | Q1+Q2+Q3 | B. | 0.5Q3-Q2+2Q1 | C. | Q3-2Q2+4Q1 | D. | 0.5(Q1+Q2+Q3) |
6.“保护环境”是我国的基本国策.下列做法不应该提倡的是( )
| A. | 推广燃煤发电,同时将化工厂迁移至人口稠密的地区 | |
| B. | 加强生活污水的脱氮除磷处理,遏制水体的富营养化 | |
| C. | 加强汽车尾气的处理,减少大气污染物的排放 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
16.已知反应:
①2CH3OH(g)?CH3OCH3(g)+H2O(g)△H1=-23.9kJ/mol
②2CH3OH(g)═C2H4(g)+2H2O(g)△H2=-29.1kJ/mol
③CH3CH2OH(g)═CH3OCH3(g)△H3=+50.7kJ/mol
在C2H4(g)+H2O(g)=CH3CH2OH(g)△H4中,△H4等于( )
①2CH3OH(g)?CH3OCH3(g)+H2O(g)△H1=-23.9kJ/mol
②2CH3OH(g)═C2H4(g)+2H2O(g)△H2=-29.1kJ/mol
③CH3CH2OH(g)═CH3OCH3(g)△H3=+50.7kJ/mol
在C2H4(g)+H2O(g)=CH3CH2OH(g)△H4中,△H4等于( )
| A. | -48.5kJ/mol | B. | +48.5kJ/mol | C. | -45.5kJ/mol | D. | +45.5kJ/mol |
3.根据能量变化示意图,下列说法正确的是( )
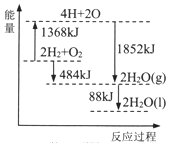

| A. | 拆开2molH2(g)和1 molO2(g)中的化学键,共放出1368 kJ能量 | |
| B. | 1 molH2和0.5molO2的能量之和比1 molH2O(1)的能量大242 kJ | |
| C. | 2H2O(g)=2H2(g)+O2(g)△H=+484KJ/mol | |
| D. | 2H2(g)+O2(g)=2H2O(1)△H=572KJ/mol |
20.铅蓄电池放电时发生的反应是:Pb+SO42--2e-═PbSO4;PbO2+4H++SO42-+2e-═PbSO4+2H2O,使用该电池时,若外电路上转移电子0.05mol,则消耗H2SO4的质量是( )
| A. | 0.05mol | B. | 0.025mol | C. | 4.9g | D. | 9.8g |
1.下列说法正确的是( )
| A. | 3C(s)+CaO(s)═CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| B. | 0.1mol/L氨水加水稀释后,溶液中$\frac{c(O{H}^{-})}{c(N{{H}_{3}•{H}_{2}O}_{\;})}$的值减小 | |
| C. | 常温常压下,22.4L Cl2中含有的分子数为6.02×1023个 | |
| D. | 合成氨时,其他条件不变,升高温度,氢气的反应速率和平衡转化率均增大 |