题目内容
18.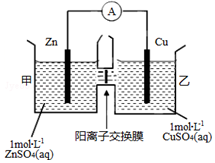 锌铜原电池装置如图所示,中间被阳离子交换膜隔开且只允许阳离子和水分子通过,下列有关叙述正确的是( )
锌铜原电池装置如图所示,中间被阳离子交换膜隔开且只允许阳离子和水分子通过,下列有关叙述正确的是( )| A. | 铜电极上发生氧化反应 | |
| B. | 外电路中电子由Cu流向Zn | |
| C. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| D. | 电池工作一段时间后,甲池的C(SO42-)增大 |
分析 由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn发生氧化反应,为负极,Cu电极上发生还原反应,为正极,阳离子交换膜只允许阳离子和水分子通过,两池溶液中硫酸根浓度不变,随反应进行,甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大.
解答 解:A.由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn为负极,发生氧化反应,Cu为正极,发生还原反应,故A错误;
B.由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn为负极,Cu为正极,电子由负极Zn流向正极Cu,故B错误;
C.甲池中的Zn2+通过阳离子交换膜进入乙池,乙池中发生反应:Cu2++2e-=Cu,保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大,故C正确;
D.阳离子交换膜只允许阳离子和水分子通过,故两池中c(SO42-)不变,故D错误,
故选:C.
点评 本题考查原电池工作原理,比较基础,注意阳离子交换膜只允许阳离子通过,C选项利用电荷守恒分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.将9g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为( )
| A. | 8g | B. | 9g | C. | 12g | D. | 13.5g |
6.“保护环境”是我国的基本国策.下列做法不应该提倡的是( )
| A. | 推广燃煤发电,同时将化工厂迁移至人口稠密的地区 | |
| B. | 加强生活污水的脱氮除磷处理,遏制水体的富营养化 | |
| C. | 加强汽车尾气的处理,减少大气污染物的排放 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
13.可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图.下列叙述正确的是( )
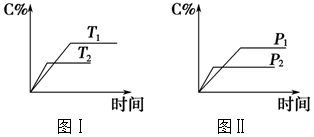

| A. | 化学方程式中m+n<e+f | |
| B. | 达平衡后,若升温,平衡左移 | |
| C. | 达平衡后,加入催化剂则C%增大 | |
| D. | 达平衡后,增加A的量有利于平衡向右移动 |
3.根据能量变化示意图,下列说法正确的是( )
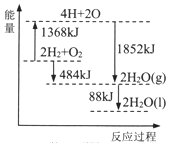

| A. | 拆开2molH2(g)和1 molO2(g)中的化学键,共放出1368 kJ能量 | |
| B. | 1 molH2和0.5molO2的能量之和比1 molH2O(1)的能量大242 kJ | |
| C. | 2H2O(g)=2H2(g)+O2(g)△H=+484KJ/mol | |
| D. | 2H2(g)+O2(g)=2H2O(1)△H=572KJ/mol |
7.设NA为阿伏加徳罗常数的值,下列说法正确的是( )
| A. | 23gNa与O2完全反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| B. | 88.0g14CO2与14N2O的混合物中所含中子数为44NA | |
| C. | 0.1L,l.0mol/L的NaAlO2水溶液中含有的氧原子数为0.2NA | |
| D. | 室温下,将1mol铁片投入到0.5L,18.4mol/L的硫酸中,转移的电子数为3NA |
8.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 足量Mg与2.8gN2完全反应后失去0.2NA电子 | |
| B. | 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA | |
| C. | 常温常压下,2.8gC2H4含有共用电子对的数目为0.6NA | |
| D. | 16gO2含有NA个18O原子 |
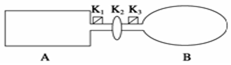 A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g)?N2O4(g)△H<0)
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g)?N2O4(g)△H<0)