题目内容
12.酸雨的形成主要原因是( )| A. | 森林乱砍乱伐 | B. | 工业上大量使用含硫燃料 | ||
| C. | 大气中二氧化碳含量增多 | D. | 汽车排放出大量尾气 |
分析 酸雨的形成主要与工业上大量燃烧含硫燃料有关,其次与汽车尾气等原因有关,以此来解答.
解答 解:A.森林遭到乱砍滥伐,破坏了生态平衡,会减少二氧化碳的吸收,与温室效应有关,故A不选;
B.工业上大量燃烧含硫燃料,使空气中二氧化硫的含量增加,为酸雨形成的主要原因,故B选;
C.大气中二氧化碳含量增多,与温室效应有关,故C不选;
D.汽车排出大量尾气,含有S的化合物、氮的化合物,主要与光化学烟雾有关,故D不选;
故选B.
点评 本题考查三废处理及环境保护,为高频考点,把握酸雨的形成、物质的性质为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.

练习册系列答案
相关题目
2.配制200mL 0.100mol•L-1盐酸溶液时,下列实验操作使所配的溶液浓度偏大的是( )
| A. | 用量筒量取所需的浓盐酸时仰视读数 | |
| B. | 用量筒量取的浓盐酸时,量筒里有少许蒸馏水 | |
| C. | 定容时,仰视标线 | |
| D. | 定容后倒转容量瓶数次摇匀,发现液面最低点低于标线,再补加几滴蒸馏水至标线 |
3.根据能量变化示意图,下列说法正确的是( )
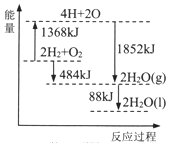

| A. | 拆开2molH2(g)和1 molO2(g)中的化学键,共放出1368 kJ能量 | |
| B. | 1 molH2和0.5molO2的能量之和比1 molH2O(1)的能量大242 kJ | |
| C. | 2H2O(g)=2H2(g)+O2(g)△H=+484KJ/mol | |
| D. | 2H2(g)+O2(g)=2H2O(1)△H=572KJ/mol |
20.铅蓄电池放电时发生的反应是:Pb+SO42--2e-═PbSO4;PbO2+4H++SO42-+2e-═PbSO4+2H2O,使用该电池时,若外电路上转移电子0.05mol,则消耗H2SO4的质量是( )
| A. | 0.05mol | B. | 0.025mol | C. | 4.9g | D. | 9.8g |
7.设NA为阿伏加徳罗常数的值,下列说法正确的是( )
| A. | 23gNa与O2完全反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| B. | 88.0g14CO2与14N2O的混合物中所含中子数为44NA | |
| C. | 0.1L,l.0mol/L的NaAlO2水溶液中含有的氧原子数为0.2NA | |
| D. | 室温下,将1mol铁片投入到0.5L,18.4mol/L的硫酸中,转移的电子数为3NA |
17.以NA表示阿佛加德罗常数,下列说法中正确的是( )
| A. | 78g过氧化钠中含2NA个O2- | |
| B. | 0.1molOH-含NA个电子 | |
| C. | 1.8g重水(D2O)中含NA个中子 | |
| D. | 标准状况下11.2L臭氧中含NA个氧原子 |
1.下列说法正确的是( )
| A. | 3C(s)+CaO(s)═CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| B. | 0.1mol/L氨水加水稀释后,溶液中$\frac{c(O{H}^{-})}{c(N{{H}_{3}•{H}_{2}O}_{\;})}$的值减小 | |
| C. | 常温常压下,22.4L Cl2中含有的分子数为6.02×1023个 | |
| D. | 合成氨时,其他条件不变,升高温度,氢气的反应速率和平衡转化率均增大 |
2.以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如图.下列说法正确的是( )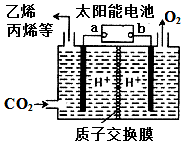

| A. | a电极为太阳能电池的正极 | |
| B. | 产生丙烯的电极反应式为:3CO2+18H++18e-═CH3CH=CH2+6H2O | |
| C. | 装置中每转移2e-,理论上有2molH+通过质子交换膜从左向右扩散 | |
| D. | 太阳能电池的原理与原电池的原理相同 |