题目内容
20.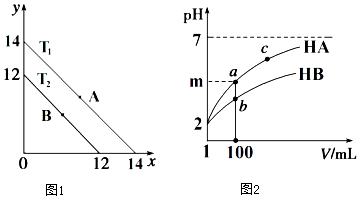 (1)溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图1所示.
(1)溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图1所示.①若从A点到B点,可采取的措施为升高温度.
②T2℃时,将pH=0的NaHSO4溶液逐滴滴加到pH=2 的醋酸溶液中,则水电离出的c(OH-)将减小(填“增大”、“减小”、“不变”).
③已知:T1℃时,醋酸的电离常数为 1.8×10-5,则 T1℃时,在 0.5mol•L-1的醋酸溶液中由醋酸电离出的 c(H+)约是水电离出的 c(H+)的倍9×108.
④T2℃时,将某溶液(此溶液满足 lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$]=10)滴入含 Na+、HS-、SO42-、K+的溶液中,发生反应的离子方程式为HS-+OH-=S2-+H2O.
(2)体积均为1mL pH=2的一元酸HA和HB,加水稀释过程中pH与溶液体积关系如图2所示:
①m的取值为2<m≤4.
②a点酸的浓度<b点酸的浓度(填“>”、“<”、“=”).
③若 m<4,常温下a点到c点的过程中,下列表达式的数据变大的是BC.
A.c(A-) B.n(H+)•n(OH-) C.$\frac{c({H}^{+})}{c({A}^{-})}$ D.$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$
(3)已知:25℃时,HCN、H2CO3 的电离平衡常数分别为K=4.9×10-10,K1=4.3×10-7、K2=5.6×10-11,向NaCN溶液中通入少量CO2,所发生反应的离子方程式为:CN-+H2O+CO2=HCN+HCO3-.
分析 (1)①A点时Kw=10-14,B点时Kw=10-12,从A点到B点Kw增大;
②将pH=0的NaHSO4溶液逐滴滴加到pH=2 的醋酸溶液中,溶液中氢离子浓度增大,根据Kw=c(H+)×c(OH-)判断;
③已知:T1℃时,醋酸的电离常数为 1.8×10-5,根据Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$计算c(H+),再根据Kw=c(H+)×c(OH-)计算;
④T2℃时,Kw=10-12,将某溶液(此溶液满足 lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$]=10),则c(H+)=10-11mol/L,溶液显碱性;
(2)①体积均为1mL pH=2的一元酸HA和HB,加水稀释100倍,pH变化为2或小于2;
②稀释相同的倍数HB的pH变化小,则HB的酸性弱;
③若 m<4,则HA为弱酸,加水稀释促进电离,n(A-)增大,但是c(A-)减小,据此分析;
(3)弱酸的电离平衡常数越大,其酸性越强,酸性强弱顺序是H2CO3>HCN>HCO3-,结合强酸能和弱酸盐反应制取弱酸分析解答.
解答 解:(1)①A点时Kw=10-14,B点时Kw=10-12,从A点到B点Kw增大,所以可采取的措施为升高温度;
故答案为:升高温度;
②将pH=0的NaHSO4溶液逐滴滴加到pH=2 的醋酸溶液中,溶液中氢离子浓度增大,由Kw=c(H+)×c(OH-)可知,c(OH-)减小,溶液中氢氧根离子由水电离,所以水电离出的c(OH-)将减小;
故答案为:减小;
③已知:T1℃时,醋酸的电离常数为 1.8×10-5,由Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$可知,c(H+)=$\sqrt{0.5×1.8×1{0}^{-5}}$=3×10-3mol/L,由Kw=c(H+)×c(OH-)=10-14可知,水电离出的 c(H+)=$\frac{1}{3}$×10-11mol/L,则由醋酸电离出的 c(H+)约是水电离出的 c(H+)的倍9×108;
故答案为:9×108;
④T2℃时,Kw=10-12,将某溶液(此溶液满足 lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$]=10),则c(H+)=10-11mol/L,溶液显碱性,所以溶液中HS-不能大量共存,发生的离子方程式为:HS-+OH-=S2-+H2O;
故答案为:HS-+OH-=S2-+H2O;
(2)①体积均为1mL pH=2的一元酸HA和HB,加水稀释100倍,若HA为强酸,则pH变化为2,若HA为弱酸,则pH变化小于2,所以m的取值范围为:2<m≤4;
故答案为:2<m≤4;
②稀释相同的倍数HB的pH变化小,则HB的酸性弱,所以a点酸的浓度<b点酸的浓度;
故答案为:<;
③若 m<4,则HA为弱酸,加水稀释促进电离,
A.加水稀释促进电离,n(A-)增大,但是c(A-)减小,故A错误;
B.c(H+)×c(OH-)不变,由于体积增大,所以n(H+)•n(OH-)增大,故B正确;
C.加水稀释促进电离,n(A-)增大,n(H+)增大,由于c(H+)减小,所以水电离的n(H+)也增大,所以$\frac{c({H}^{+})}{c({A}^{-})}$ 增大,故C正确;
D.$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$=$\frac{1}{{K}_{h}}$,由于水解常数Kh不变,所以$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$不变,故D错误.
故答案为:BC;
(3)依据强酸制取弱酸的原理,NaCN溶液中通入少量的CO2离子方程式为:CN-+H2O+CO2=HCN+HCO3-,
故答案为:CN-+H2O+CO2=HCN+HCO3-.
点评 本题考查了酸碱混合时的定性判断和pH的有关计算、弱电解质的电离,明确Ka与酸性的关系、弱酸的电离度与浓度的关系及图象分析为解答的关键,侧重分析与应用能力的考查,题目难度中等.

| A. | 开发废旧电池综合利用技术,防止重金属盐对土壤水资源造成污染 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 倡导低碳生活,使用太阳能、风能等代替化石燃料,可减少温室气体的排放 | |
| D. | 垃圾是放错地方的资源,应分类回收利用 |
| A. | 将20gNaOH溶解在500mL水中 | |
| B. | 将22.4L HCl气体溶于水配成1 L溶液 | |
| C. | 将1 L 10 mol•L-1浓盐酸加入9L水中 | |
| D. | 将10gNaOH溶解在少量水中,恢复至室温,再加蒸馏水直到溶液体积为250mL |

 某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验.
某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验.