题目内容
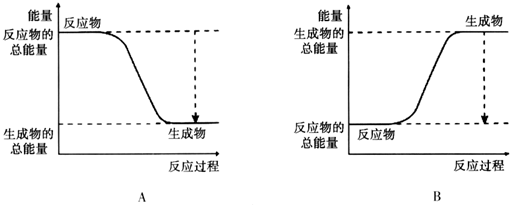
如表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
(1)D的氢化物比G的氢化物稳定,其原因是
(2)在一定条件下,A与E可形成一种极易溶于水的气态化合物,该物质溶于水后的溶液呈 性(填“酸”、“碱”或“中”).
(3)由I形成的单质与水化学反应方程式
(4)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由表中的 (填字母序号)元素组成的,用化学方程式表示吸收原理: ,飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体化学式为 .
| ⅠA | 0 | ||||||
| A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | B |
| D | E | F | I | ||||
| C | G | H |
(2)在一定条件下,A与E可形成一种极易溶于水的气态化合物,该物质溶于水后的溶液呈
(3)由I形成的单质与水化学反应方程式
(4)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由表中的
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中的位置可知,A为氢、B为He、C为Na、D为碳、E为氮、F为氧、G为Si、H为Cl、I为F,
(1)非金属性越强,氢化物越稳定;
(2)H与N元素形成极易溶于水的气态化合物为NH3,溶于水所得溶液呈碱性;
(3)氟气与水反应生成HF与氧气;
(4)Na2O2可吸收二氧化碳并放出氧气,空气的主要成分为氮气和氧气,则在氧气中充入N2稀释气体.
(1)非金属性越强,氢化物越稳定;
(2)H与N元素形成极易溶于水的气态化合物为NH3,溶于水所得溶液呈碱性;
(3)氟气与水反应生成HF与氧气;
(4)Na2O2可吸收二氧化碳并放出氧气,空气的主要成分为氮气和氧气,则在氧气中充入N2稀释气体.
解答:
解:由元素在周期表中的位置可知,A为氢、B为He、C为Na、D为碳、E为氮、F为氧、G为Si、H为Cl、I为F,
(1)由于非金属性C>Si,故C元素氢化物比Si元素氢化物稳定,
故答案为:碳元素非金属性比Si强;
(2)H与N元素形成极易溶于水的气态化合物为NH3,水溶液中一水合氨发生电离:NH3?H2O?NH4++OH-,溶液呈碱性,
故答案为:碱;
(3)氟气与水反应生成HF与氧气,反应方程式为:2F2+2H2O=4HF+O2,
故答案为:2F2+2H2O=4HF+O2;
(4)飞船内需要有一种化合物来吸收航天员呼出的CO2,该物质为过氧化钠,则由上表中的C、F组成,该反应为:2Na2O2+2CO2=2Na2CO3+O2,空气的主要成分为氮气和氧气,则在氧气中充入N2稀释气体,
故答案为:C、F;2Na2O2+2CO2=2Na2CO3+O2;N2.
(1)由于非金属性C>Si,故C元素氢化物比Si元素氢化物稳定,
故答案为:碳元素非金属性比Si强;
(2)H与N元素形成极易溶于水的气态化合物为NH3,水溶液中一水合氨发生电离:NH3?H2O?NH4++OH-,溶液呈碱性,
故答案为:碱;
(3)氟气与水反应生成HF与氧气,反应方程式为:2F2+2H2O=4HF+O2,
故答案为:2F2+2H2O=4HF+O2;
(4)飞船内需要有一种化合物来吸收航天员呼出的CO2,该物质为过氧化钠,则由上表中的C、F组成,该反应为:2Na2O2+2CO2=2Na2CO3+O2,空气的主要成分为氮气和氧气,则在氧气中充入N2稀释气体,
故答案为:C、F;2Na2O2+2CO2=2Na2CO3+O2;N2.
点评:本题考查元素周期表及元素单质化合物的性质,明确元素种类解答的关键,注意全面掌握基础知识,难度不大.

练习册系列答案
相关题目
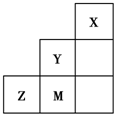
如图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是( )
 ??
??
 ??
??| A、非金属性:Y>Z>M |
| B、离子半径:M->Z2->Y- |
| C、Z元素最高价氧化物的对应水化物的浓溶液具有强氧化性和不挥发性 |
| D、三种元素中,Y的最高价氧化物对应的水化物酸性最强 |
下列电池中不属于二次电池的是( )
| A、碱性锌锰电池 | B、铅蓄电池 |
| C、镍镉电池 | D、锂离子电池 |






 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下: