题目内容
从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O.
(1)为了加快正反应速率,可以采取的措施有 (填序号,下同).
A.使用催化剂 B.提高氧气的浓度
C.提高反应的温度 D.降低反应的温度
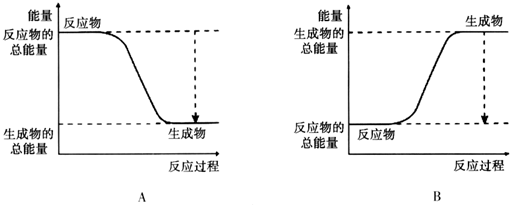
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是 .
(3)从断键和成键的角度分析上述反应中能量的变化.已知:化学键的键能:
由此计算2mol H2在氧气中燃烧生成气态水放出的热量
(4)已知1克氢气完全燃烧生成液态水放出QKJ的热量,则氢气燃烧生成液态水的热化学反应方程式为
(5)氢氧燃料电池的总反应方程式为2H2+O2═2H2O.其中,氢气在 (填“正”或“负”)极发生 反应(填“氧化”或“还原”).电路中每转移0.2mol电子,标准状况下消耗H2的体积是 L.
(1)为了加快正反应速率,可以采取的措施有
A.使用催化剂 B.提高氧气的浓度
C.提高反应的温度 D.降低反应的温度
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是

(3)从断键和成键的角度分析上述反应中能量的变化.已知:化学键的键能:
| 化学键 | H-H | O=O | H-O |
| 键能kJ?mol-1 | 436 | 496 | 463 |
(4)已知1克氢气完全燃烧生成液态水放出QKJ的热量,则氢气燃烧生成液态水的热化学反应方程式为
(5)氢氧燃料电池的总反应方程式为2H2+O2═2H2O.其中,氢气在
考点:化学反应速率的影响因素,反应热和焓变,热化学方程式,化学电源新型电池
专题:基本概念与基本理论
分析:(1)增大反应物浓度、使用催化剂、升高温度等均可加快反应速率;
(2)放热反应中反应物的总能量大于生成物的总能量;
(3)断裂化学键吸收能量,形成化学键释放能量,△H=反应物中键能之和-生成物中键能之和;
(4)根据热化学方程式中焓变和方程式系数之间的关系以及热化学方程式的书写方法来回答;
(5)H元素的化合价升高,则氢气在负极失去电子,发生氧化反应,反应中消耗2molH2转移4mol电子,以此解答
(2)放热反应中反应物的总能量大于生成物的总能量;
(3)断裂化学键吸收能量,形成化学键释放能量,△H=反应物中键能之和-生成物中键能之和;
(4)根据热化学方程式中焓变和方程式系数之间的关系以及热化学方程式的书写方法来回答;
(5)H元素的化合价升高,则氢气在负极失去电子,发生氧化反应,反应中消耗2molH2转移4mol电子,以此解答
解答:
解:(1)A.使用催化剂,加快反应速率,故A选;
B.适当提高氧气的浓度,反应物浓度增大,反应速率加快,故B选
C.适当提高反应的温度,反应速率加快,故C选;
D.适当降低反应的温度,反应速率减慢,故D不选;
故答案为:ABC;
(2)由图可知,A中反应物的总能量大于生成物的总能量,为放热反应,故答案为:A;
(3)断裂2molH2中的化学键吸收2×436kJ热量,断裂1molO2中的化学键吸收496kJ热量,共吸收2×436+496=1368kJ热量,形成4molH-O键释放4×463kJ=1852kJ热量,2mol H2在氧气中燃烧生成气态水的反应热△H=反应物中键能之和-生成物中键能之和=1368-1852kJ/mol=-484kJ/mol,即2mol H2在氧气中燃烧生成气态水放出的热量为484kJ,故答案为:484kJ;
(4)1克氢气完全燃烧生成液态水放出QKJ的热量,则4克氢气完全燃烧生成液态水放出4QKJ的热量,氢气燃烧生成液态水的热化学反应方程式为2H2 (g)+O2(g)=2H2O(l)△H=-4QKJ/mol,故答案为:2H2 (g)+O2(g)=2H2O(l)△H=-4QKJ/mol;
(5)H元素的化合价升高,则氢气在负极失去电子,发生氧化反应,反应中消耗2molH2转移4mol电子,则电路中每转移0.2mol电子,标准状况下消耗H2的体积是0.1mol×22.4L/mol=2.24L,故答案为:负;氧化;2.24.
B.适当提高氧气的浓度,反应物浓度增大,反应速率加快,故B选
C.适当提高反应的温度,反应速率加快,故C选;
D.适当降低反应的温度,反应速率减慢,故D不选;
故答案为:ABC;
(2)由图可知,A中反应物的总能量大于生成物的总能量,为放热反应,故答案为:A;
(3)断裂2molH2中的化学键吸收2×436kJ热量,断裂1molO2中的化学键吸收496kJ热量,共吸收2×436+496=1368kJ热量,形成4molH-O键释放4×463kJ=1852kJ热量,2mol H2在氧气中燃烧生成气态水的反应热△H=反应物中键能之和-生成物中键能之和=1368-1852kJ/mol=-484kJ/mol,即2mol H2在氧气中燃烧生成气态水放出的热量为484kJ,故答案为:484kJ;
(4)1克氢气完全燃烧生成液态水放出QKJ的热量,则4克氢气完全燃烧生成液态水放出4QKJ的热量,氢气燃烧生成液态水的热化学反应方程式为2H2 (g)+O2(g)=2H2O(l)△H=-4QKJ/mol,故答案为:2H2 (g)+O2(g)=2H2O(l)△H=-4QKJ/mol;
(5)H元素的化合价升高,则氢气在负极失去电子,发生氧化反应,反应中消耗2molH2转移4mol电子,则电路中每转移0.2mol电子,标准状况下消耗H2的体积是0.1mol×22.4L/mol=2.24L,故答案为:负;氧化;2.24.
点评:本题考查较综合,涉及化学反应速率的影响因素、化学键及反应中能量变化、原电池等,为高频考点,侧重化学反应原理的考查,有利于基础知识的夯实,题目难度不大.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
某溶液能与锌片作用产生H2,则该溶液中可以大量共存的离子组是( )
| A、Na+、NO3-、K+、Fe2+ |
| B、Fe2+、Na+、SO42-、K+ |
| C、K+、I-、NO3-、H+ |
| D、NH4+、NO3-、Na+、HCO3- |
BHT是一种常用的食品抗氧化剂,从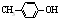 出发合成BHT的方法有如图两种.下列说法错误的是( )
出发合成BHT的方法有如图两种.下列说法错误的是( )
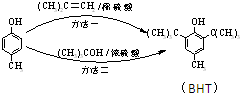
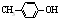 出发合成BHT的方法有如图两种.下列说法错误的是( )
出发合成BHT的方法有如图两种.下列说法错误的是( )
| A、两种方法的反应类型都是加成反应 |
| B、BHT在水中的溶解度小于苯酚 |
C、BHT与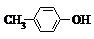 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 |
| D、从绿色化学角度分析方法一优于方法二 |
有 Fe3+、Fe2+、NO3-、NH4+、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述中,不正确的是( )
| A、还原产物为NH4+ |
| B、氧化剂与还原剂的物质的量之比为1:8 |
| C、若有0.5mol NO3-参加还原反应,则转移电子8mol |
| D、若把该反应设计为电解池,则阳极反应为Fe2+-e→Fe3+ |