��Ŀ����
��ҵ������ʱ�����ô�������Ӧ��SO2ת��ΪSO3��һ���ؼ��IJ��裮
��1��ij�¶��£�SO2��g��+
O2��g��?S��3��g����H=-98kJ?mol-1����ʼʱ��100L���ܱ������м���4.0mol SO2��g����10.0mol O2��g��������Ӧ�ﵽƽ��ʱ���ų�����196kJ�����¶���ƽ�ⳣ��K= �����÷�����ʾ����
��2��һ�������£���һ���������ܱ������г���2molSO2��1molO2���������з�Ӧ��2SO2��g��+O2��g��??2SO3��g�����ﵽƽ���ı�����������SO2��O2��SO3����ƽ��Ũ�ȶ���ԭ��������� ������ĸ����
A�������¶Ⱥ�����������䣬����2mol SO3
B�������¶Ⱥ�����������䣬����2mol N2
C�������¶Ⱥ�����������䣬����0.5mol SO2��0.25mol O2
D�������¶Ⱥ�������ѹǿ���䣬����1mol SO3
E�������¶�
F���ƶ�����ѹ������
��3��ij����������ͼ��ʾװ���õ绯ѧԭ���������ᣬд��ͨ��SO2�ĵ缫�ĵ缫��Ӧʽ�� ��

��4������ʱ��BaSO4��Ksp=1.08��10-10���ֽ��������BaCl2��Һ��2.0��10-3 mol?L-1��Na2SO4��Һ��ϣ���Ҫ����BaSO4������BaCl2��Һ����СŨ��Ϊ ��
��5����ͼ����2SO2��g��+O2��g��?2SO3��g����Ӧ��ͼ���У�������ȷ���� ������ţ���

��6����ij�¶��£�SO2��ƽ��ת���ʣ���������ϵ��ѹǿ��p���Ĺ�ϵ����ͼ��ʾ��ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ����K��A�� K��B�������������������=������

�ڽ�һ������SO2��g����O2��g������ij�̶�������ܱ������У���һ�������£�c��SO3���ı仯����ͼ��ʾ�����ڵ�5���ӽ������������Сһ����ڵ�8���Ӵﵽ�µ�ƽ�⣨��ʱSO3��Ũ��Ϊ0.25mol?L-1��������ͼ�л����˱仯������SO3��G��Ũ�ȵı仯���ߣ�

��1��ij�¶��£�SO2��g��+
| 1 |
| 2 |
��2��һ�������£���һ���������ܱ������г���2molSO2��1molO2���������з�Ӧ��2SO2��g��+O2��g��??2SO3��g�����ﵽƽ���ı�����������SO2��O2��SO3����ƽ��Ũ�ȶ���ԭ���������
A�������¶Ⱥ�����������䣬����2mol SO3
B�������¶Ⱥ�����������䣬����2mol N2
C�������¶Ⱥ�����������䣬����0.5mol SO2��0.25mol O2
D�������¶Ⱥ�������ѹǿ���䣬����1mol SO3
E�������¶�
F���ƶ�����ѹ������
��3��ij����������ͼ��ʾװ���õ绯ѧԭ���������ᣬд��ͨ��SO2�ĵ缫�ĵ缫��Ӧʽ��

��4������ʱ��BaSO4��Ksp=1.08��10-10���ֽ��������BaCl2��Һ��2.0��10-3 mol?L-1��Na2SO4��Һ��ϣ���Ҫ����BaSO4������BaCl2��Һ����СŨ��Ϊ
��5����ͼ����2SO2��g��+O2��g��?2SO3��g����Ӧ��ͼ���У�������ȷ����

��6����ij�¶��£�SO2��ƽ��ת���ʣ���������ϵ��ѹǿ��p���Ĺ�ϵ����ͼ��ʾ��ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ����K��A��

�ڽ�һ������SO2��g����O2��g������ij�̶�������ܱ������У���һ�������£�c��SO3���ı仯����ͼ��ʾ�����ڵ�5���ӽ������������Сһ����ڵ�8���Ӵﵽ�µ�ƽ�⣨��ʱSO3��Ũ��Ϊ0.25mol?L-1��������ͼ�л����˱仯������SO3��G��Ũ�ȵı仯���ߣ�

���㣺��ѧƽ��ļ���,��ѧƽ���Ӱ������,���ܵ���ʵ��ܽ�ƽ�⼰����ת���ı���,���ԭ��
ר�⣺��ѧƽ��ר��,����ƽ������Һ��pHר��,�绯ѧר��
��������1����������ʽ������ƽ��Ũ�ȣ�����ƽ�ⳣ������ʽ���㣻
��2������ƽ���ƶ��ķ����жϣ�
��3��ԭ��ظ�������������Ӧ��SO2����������SO42-��
��4�������Ϻ��������Ũ�ȣ�����Ksp��BaSO4��=c��Ba2+��?c��SO42-���������������ʱ��Һ��c��Ba2+����ԭ�Ȼ�����ҺΪ��ʱ������Ũ�ȵ�2����ע����Һ��Ϻ�������ʵ�Ũ�Ƚ�Ϊԭ����һ�룻
��5�������¶ȣ��ӿ췴Ӧ���ʵ���ƽ����ʱ�����̣��淴Ӧ����������࣬ƽ�����淴Ӧ�����ƶ�����������ĺ������ͣ�����ѹǿ���ӿ췴Ӧ���ʵ���ƽ����ʱ�����̣�����Ӧ����������࣬ƽ��������Ӧ�����ƶ�����������ĺ������ݴ˽��ͼ���жϣ�
��6����ƽ�ⳣ�����¶ȱ仯������ѹǿ�仯��
���ڵ�5����ĩ�������������Сһ���ѹǿ����ƽ��������У����ڵ�8����ĩ�ﵽ�µ�ƽ�⣨��ʱSO3��Ũ��ԼΪ0.25mol/L����������������Ũ�ȱ仯����ƽ��Ũ�Ȼ����仯ͼ��
��2������ƽ���ƶ��ķ����жϣ�
��3��ԭ��ظ�������������Ӧ��SO2����������SO42-��
��4�������Ϻ��������Ũ�ȣ�����Ksp��BaSO4��=c��Ba2+��?c��SO42-���������������ʱ��Һ��c��Ba2+����ԭ�Ȼ�����ҺΪ��ʱ������Ũ�ȵ�2����ע����Һ��Ϻ�������ʵ�Ũ�Ƚ�Ϊԭ����һ�룻
��5�������¶ȣ��ӿ췴Ӧ���ʵ���ƽ����ʱ�����̣��淴Ӧ����������࣬ƽ�����淴Ӧ�����ƶ�����������ĺ������ͣ�����ѹǿ���ӿ췴Ӧ���ʵ���ƽ����ʱ�����̣�����Ӧ����������࣬ƽ��������Ӧ�����ƶ�����������ĺ������ݴ˽��ͼ���жϣ�
��6����ƽ�ⳣ�����¶ȱ仯������ѹǿ�仯��
���ڵ�5����ĩ�������������Сһ���ѹǿ����ƽ��������У����ڵ�8����ĩ�ﵽ�µ�ƽ�⣨��ʱSO3��Ũ��ԼΪ0.25mol/L����������������Ũ�ȱ仯����ƽ��Ũ�Ȼ����仯ͼ��
���
�⣺��1��SO2��g��+
O2��g��?SO3��g������H=-98kJ?mol-1��
��100L���ܱ������м���4.0mol SO2��g����10.0molO2��g��������Ӧ�ﵽƽ��ʱ���ų�����196kJ��������SO22mol��
SO2��g��+
O2��g��?SO3��g��
��ʼ 4.0mol 10.0mol 0
ת����2.0mol 1.0mol 2mol
ƽ�⣺2.0mol 9.0mol 2.0mol
��ƽ��ʱ��c��SO2��=0.02mol/L��c��O2��=0.09mol/L��c��SO3��=0.02mol/L��
����k=
=
=0.3��
�ʴ�Ϊ��0.3��
��2��A�������¶Ⱥ�����������䣬����2mol SO3��ƽ�����淴Ӧ�����ƶ�����SO2��O2��SO3����ƽ��Ũ�ȶ���ԭ������A��ȷ��
B�������¶Ⱥ�����������䣬����2mol N2����ƽ���ƶ�û��Ӱ�죬�����ʵ�Ũ�Ȳ��䣬��B����
C�������¶Ⱥ�����������䣬����0.5mol SO2��0.25mol O2��ƽ��������Ӧ�����ƶ�����SO2��O2��SO3����ƽ��Ũ�ȶ���ԭ������C��ȷ��
D�������¶Ⱥ�������ѹǿ���䣬����1mol SO3�����ڵ�Чƽ��״̬��Ũ�Ȳ��䣬��D����
E�������¶ȣ�ƽ�����淴Ӧ�����ƶ���SO3��Ũ�ȼ�С����E����
F���ƶ�����ѹ�����壬�����С�������ʵ�Ũ�ȶ�����F��ȷ��
�ʴ�Ϊ��A��C��F��
��3��ԭ��ظ�������������Ӧ��SO2����������SO42-�������缫��ӦʽΪSO2+2H2O-2e-=SO42-+4H+��
�ʴ�Ϊ��SO2+2H2O-2e-=SO42-+4H+��
��4���������Ϻ�c��SO42-��=
��0.002mol/L=0.001mol/L����BaSO4��������Ba2+���ӵ���СŨ��Ϊc��Ba2+��=
mol/L=1.08��10-7mol/L����ԭBaCl2��Һ��Ũ��Ϊ2��1.08��10-7mol/L=3.16��10-7mol/L��
�ʴ�Ϊ��3.16��10-7mol/L��
��5��A�������¶ȣ��淴Ӧ����������࣬ƽ�����淴Ӧ�����ƶ���ͼ����ʵ�ʷ��ϣ���A��ȷ��
B�������¶ȣ�ƽ�����淴Ӧ�����ƶ�����������ĺ������ͣ�ͼ����ʵ�ʷ��ϣ���B��ȷ��
C�������¶ȣ��ӿ췴Ӧ���ʵ���ƽ����ʱ�����̣��淴Ӧ����������࣬ƽ�����淴Ӧ�����ƶ�����������ĺ������ͣ�ͼ����ʵ�ʲ�������C����
D������ѹǿ���ӿ췴Ӧ���ʵ���ƽ����ʱ�����̣�����Ӧ����������࣬ƽ��������Ӧ�����ƶ�����������ĺ�������ͼ����ʵ�ʷ��ϣ���D��ȷ��
�ʴ�Ϊ��C��
��6����ƽ�ⳣ��ֻ���¶��йأ���ѹǿ�أ����¶Ȳ���������£�����ѹǿ�����仯��ƽ�ⳣ�������䣻
�ʴ�Ϊ��=��
���ڵ�5����ĩ�������������Сһ���ѹǿ����ƽ��������У����ڵ�8����ĩ�ﵽ�µ�ƽ�⣨��ʱSO3��Ũ��ԼΪ0.25mol/L����������������Ũ�ȱ仯��ƽ��Ũ�Ȼ����仯ͼ��Ϊ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
| 1 |
| 2 |
��100L���ܱ������м���4.0mol SO2��g����10.0molO2��g��������Ӧ�ﵽƽ��ʱ���ų�����196kJ��������SO22mol��
SO2��g��+
| 1 |
| 2 |
��ʼ 4.0mol 10.0mol 0
ת����2.0mol 1.0mol 2mol
ƽ�⣺2.0mol 9.0mol 2.0mol
��ƽ��ʱ��c��SO2��=0.02mol/L��c��O2��=0.09mol/L��c��SO3��=0.02mol/L��
����k=
c(SO2)
| ||
| c(SO3) |
0.02��
| ||
| 0.02 |
�ʴ�Ϊ��0.3��
��2��A�������¶Ⱥ�����������䣬����2mol SO3��ƽ�����淴Ӧ�����ƶ�����SO2��O2��SO3����ƽ��Ũ�ȶ���ԭ������A��ȷ��
B�������¶Ⱥ�����������䣬����2mol N2����ƽ���ƶ�û��Ӱ�죬�����ʵ�Ũ�Ȳ��䣬��B����
C�������¶Ⱥ�����������䣬����0.5mol SO2��0.25mol O2��ƽ��������Ӧ�����ƶ�����SO2��O2��SO3����ƽ��Ũ�ȶ���ԭ������C��ȷ��
D�������¶Ⱥ�������ѹǿ���䣬����1mol SO3�����ڵ�Чƽ��״̬��Ũ�Ȳ��䣬��D����
E�������¶ȣ�ƽ�����淴Ӧ�����ƶ���SO3��Ũ�ȼ�С����E����
F���ƶ�����ѹ�����壬�����С�������ʵ�Ũ�ȶ�����F��ȷ��
�ʴ�Ϊ��A��C��F��
��3��ԭ��ظ�������������Ӧ��SO2����������SO42-�������缫��ӦʽΪSO2+2H2O-2e-=SO42-+4H+��
�ʴ�Ϊ��SO2+2H2O-2e-=SO42-+4H+��
��4���������Ϻ�c��SO42-��=
| 1 |
| 2 |
| 1.08��10-10 |
| 0.001 |
�ʴ�Ϊ��3.16��10-7mol/L��
��5��A�������¶ȣ��淴Ӧ����������࣬ƽ�����淴Ӧ�����ƶ���ͼ����ʵ�ʷ��ϣ���A��ȷ��
B�������¶ȣ�ƽ�����淴Ӧ�����ƶ�����������ĺ������ͣ�ͼ����ʵ�ʷ��ϣ���B��ȷ��
C�������¶ȣ��ӿ췴Ӧ���ʵ���ƽ����ʱ�����̣��淴Ӧ����������࣬ƽ�����淴Ӧ�����ƶ�����������ĺ������ͣ�ͼ����ʵ�ʲ�������C����
D������ѹǿ���ӿ췴Ӧ���ʵ���ƽ����ʱ�����̣�����Ӧ����������࣬ƽ��������Ӧ�����ƶ�����������ĺ�������ͼ����ʵ�ʷ��ϣ���D��ȷ��
�ʴ�Ϊ��C��
��6����ƽ�ⳣ��ֻ���¶��йأ���ѹǿ�أ����¶Ȳ���������£�����ѹǿ�����仯��ƽ�ⳣ�������䣻
�ʴ�Ϊ��=��
���ڵ�5����ĩ�������������Сһ���ѹǿ����ƽ��������У����ڵ�8����ĩ�ﵽ�µ�ƽ�⣨��ʱSO3��Ũ��ԼΪ0.25mol/L����������������Ũ�ȱ仯��ƽ��Ũ�Ȼ����仯ͼ��Ϊ
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
���������⿼���˻�ѧ��Ӧ���ʵĶ�����ʾ��������ѧƽ�ⳣ������ѧƽ���Ӱ�����ص�֪ʶ�㣬ͬһ��ѧ��Ӧ�л�ѧƽ�ⳣ��ֻ���¶��йأ��뷴Ӧ��������Ũ���أ��ؼ���ͼ�����ƽ��Ũ�ȣ��ͷ�Ӧ�ȵĺ������⣬��Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
����Cu2O��һ����;�㷺�Ĺ����ϣ������������ֵ绯ѧװ���Ʊ����ֲ��ϣ������й�˵������ȷ���ǣ�������


| A�������ϵĵ缫��Ӧ��Ϊ2Cu-2e-+2OH-�TCu2O+H2O |
| B����������������װ������Һ��pH����С |
| C������װ���������Ӿ�����ͭ�缫 |
| D�������Ͽ�ʼʱ������������ |
����ʽΪC7H14O2���л��������������¿�ˮ��Ϊ��ʹ��������ɵĴ�û����ͬ�Ĺ����ŵ�ͬ���칹�壮�������������칹����Щ��ʹ�������Ͽ��γɵ������У�������
| A��8�� | B��16�� |
| C��24�� | D��28�� |
��NA���������ӵ�������ֵ������˵����ȷ���ǣ�������
| A�������£�pH=7���κ���Һ�к���OH-��Ŀ��Ϊ10-7NA |
| B��23g�Ҵ��к���C-H������ĿΪ3NA |
| C��4.8g O2��O3���κα�����ɵĻ�������к��е���ԭ����Ŀ��Ϊ0.3NA |
| D�����³�ѹ�£�2.24L Cl2���������۳�ַ�Ӧ��ת�Ƶĵ�����ĿΪ0.2NA |
ij��Һ����пƬ���ò���H2�������Һ�п��Դ���������������ǣ�������
| A��Na+��NO3-��K+��Fe2+ |
| B��Fe2+��Na+��SO42-��K+ |
| C��K+��I-��NO3-��H+ |
| D��NH4+��NO3-��Na+��HCO3- |
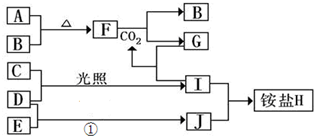
 A���ɵ��Ȳ����Ƴɵ��ܱ�������B��һ�ͻ�ѧ��ʴ���״��ȵ����ر�K2����������������NO2ͨ��K1��K3�ֱ����A��B�У���Ӧ��ʼʱ��A��B�������ΪV L��
A���ɵ��Ȳ����Ƴɵ��ܱ�������B��һ�ͻ�ѧ��ʴ���״��ȵ����ر�K2����������������NO2ͨ��K1��K3�ֱ����A��B�У���Ӧ��ʼʱ��A��B�������ΪV L��