��Ŀ����
9��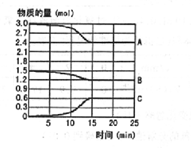 ��600��ʱ����һ������SO2��O2����һ���ݻ��̶�Ϊ2L���ܱ������У���Ӧ�����и������ʵ�����ʱ��ı仯��ͼ��ʾ��
��600��ʱ����һ������SO2��O2����һ���ݻ��̶�Ϊ2L���ܱ������У���Ӧ�����и������ʵ�����ʱ��ı仯��ͼ��ʾ����ش��������⣮
��1��SO2��O2�����������·�����Ӧ�Ļ�ѧ����ʽ��2SO2+O2$\frac{\underline{����}}{��}$2SO3���÷�Ӧ�е���������O2��
��2������ͼ��֪��A������������SO2����A��Ũ�ȱ仯��ʾ�÷�Ӧ��0��15min�ڵĻ�ѧ��Ӧ������0.02mol/L•min��
��3��15min��A��B��C�����ʵ������ٸı��ԭ���Ǵﵽ�˻�ѧƽ��״̬��
��4������߸÷�Ӧ�Ļ�ѧ��Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩ�Ǽ�������������¶ȣ�
���� ��1���������������������Ӧ������������Ӧ�ǿ��淴Ӧ��Ԫ�ػ��ϼ۽��͵����ʵõ�������������������ԭ��Ӧ��
��2����Ӧ�����ʵ����淴Ӧ���м�С�����������ʵ�������һ��ʱ�̲��ٱ仯����Ӧ�ﵽƽ��״̬�����ݱ仯���ʵ���֮�Ⱥͻ�ѧ����ʽ������֮�ȼ����������Ӧ����V=$\frac{��c}{��t}$��
��3��ͼ�������֪���������ʵ�������˵�����淴Ӧ������ͬ����Ӧ�ﵽƽ��״̬��
��4�����¡�����ѹǿ������Ũ�ȡ���������ȿ�������Ӧ���ʣ�
��� �⣺��1����SO2��O2�����������·�����Ӧ�Ļ�ѧ����ʽ��2SO2+O2$\frac{\underline{����}}{��}$2SO3����Ӧ����������Ԫ�ػ��ϼ�0�۱仯Ϊ-2�ۣ�Ԫ�ػ��ϼ۽���������������������
�ʴ�Ϊ��2SO2+O2$\frac{\underline{����}}{��}$2SO3��O2��
��2����Ӧ�����ʵ����淴Ӧ���м�С�����������ʵ�������һ��ʱ�̲��ٱ仯����Ӧ�ﵽƽ��״̬����Ӧ�����ʵı仯��Ϊ��AΪ3.0mol-2.4mol=0.60mol�����ʵ����仯Ϊ��1.5mol-1.2mol=0.3mol��C���ʵ����仯Ϊ��0.60mol����A��B��C���ʵ���֮��=0.60��0.30��0.60mol=2��1��2����AΪSO2��BΪO2��CΪSO3����A��Ũ�ȱ仯��ʾ�÷�Ӧ��0��15min�ڵĻ�ѧ��Ӧ����=$\frac{\frac{0.60mol}{2L}}{15min}$=0.02mol/L•min��
�ʴ�Ϊ��SO2��0.02��
��3��ͼ�������֪���������ʵ�������˵�����淴Ӧ������ͬ����Ӧ�ﵽƽ��״̬��15min��A��B��C�����ʵ������ٸı��ԭ���Ǵﵽ�˻�ѧƽ��״̬��
�ʴ�Ϊ���ﵽ�˻�ѧƽ��״̬��
��4������߸÷�Ӧ�Ļ�ѧ��Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩ�Ǽ�����������¡���ѹ�ȣ�
�ʴ�Ϊ����������������¶ȣ�
���� ���⿼����ͼ�������Ӱ�컯ѧ��Ӧ���ʵ�Ԫ�ء���ѧ��Ӧ���ʼ����֪ʶ�㣬���ջ����ǽ���ؼ�����Ŀ�ϼ�

 ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д� �����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д� Сѧ�����ҵ���ϴ�ѧ������ϵ�д�
Сѧ�����ҵ���ϴ�ѧ������ϵ�д�| A�� | ���������ʱ�����ɵ��������������ӵ����� | |
| B�� | ���������ʱ�����ɵ������������������ӵ��Ǽ� | |
| C�� | ���������ʱ�����ɽ��������Ӻ�������ӵ����� | |
| D�� | NH4Cl�ĵ��뷽��ʽ�ǣ�NH4Cl�TNH4++Cl-��NH4+���ǽ��������ӣ�����NH4Cl������ |
| A�� | C2H6 | B�� | C2H2 | C�� | C3H6 | D�� | C6H6 |
| A�� | ���� | B�� | ���� | C�� | ���� | D�� | ���� |
 ��B��
��B�� ��C��
��C�� ��
�� +2NaOH$��_{��}^{��}$
+2NaOH$��_{��}^{��}$