题目内容
1.NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 39g苯中含有C═C键数为1.5NA | |
| B. | 0.5molFeBr2与标准状况下33.6L氯气反应时转移电子数为3NA | |
| C. | 1L0.5mol•L-1的NaClO溶液中含有的ClO-离子数为0.5NA | |
| D. | 常温常压下,14g由C2H4和C3H6组成的混合气体中含有的原子总数为3NA |
分析 A、苯不是单双键交替的结构;
B、0.5molFeBr2被完全氧化时,会失去1.5mol电子;
C、ClO-是弱酸根,在溶液中会水解;
D、C2H4和C3H6的最简式均为CH2.
解答 解:A、苯不是单双键交替的结构,故苯中无碳碳双键,故A错误;
B、0.5molFeBr2被完全氧化时,会失去1.5mol电子,消耗0.75mol氯气即可,而标况下33.6L氯气的物质的量为1.5mol,故和FeBr2反应时氯气过量,故在反应过程中转移1.5mol电子即1.5NA个,故B错误;
C、ClO-是弱酸根,在溶液中会水解,故溶液中的次氯酸根的个数小于0.5NA个,故C错误;
D、C2H4和C3H6的最简式均为CH2,故14g混合物中含有的CH2的物质的量为1mol,则含3mol原子即3NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
11.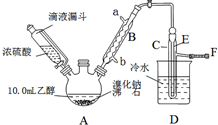 实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑.CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见表:
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑.CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见表:
(1)A装置的名称是三颈烧瓶.
(2)实验中用滴液漏斗代替分液漏斗的优点为平衡压强,使浓硫酸顺利流下.
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的化学方程式2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O.
(4)给A加热的目的是升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动,F接橡皮管导入稀NaOH溶液,其目的主要是吸收SO2、Br2、HBr防止空气污染.
(5)图中C中的导管E的末端须在水面以下,其目的是使溴乙烷充分冷凝,提高产率.
(6)为了除去产品中的主要杂质,最好选择下列C(选填序号)溶液来洗涤所得粗产品.
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(7)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g.
①在上述提纯过程中每次分液时产品均从分液漏斗的下口(上口或下口)取得.
②从乙醇的角度考虑,本实验所得溴乙烷的产率是53.3%.
 实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑.CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见表:
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑.CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
| 密度/(g•cm-3) | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
(2)实验中用滴液漏斗代替分液漏斗的优点为平衡压强,使浓硫酸顺利流下.
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的化学方程式2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O.
(4)给A加热的目的是升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动,F接橡皮管导入稀NaOH溶液,其目的主要是吸收SO2、Br2、HBr防止空气污染.
(5)图中C中的导管E的末端须在水面以下,其目的是使溴乙烷充分冷凝,提高产率.
(6)为了除去产品中的主要杂质,最好选择下列C(选填序号)溶液来洗涤所得粗产品.
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(7)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g.
①在上述提纯过程中每次分液时产品均从分液漏斗的下口(上口或下口)取得.
②从乙醇的角度考虑,本实验所得溴乙烷的产率是53.3%.
10.甲基叔丁基醚可制成针剂,用于治疗胆固醇型的胆结石病,在下列诸合成路线中,最佳合成路线是( )
| A. | 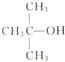 、CH3OH和浓硫酸共热 、CH3OH和浓硫酸共热 | B. | 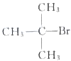 和CH3ONa共热 和CH3ONa共热 | ||
| C. | CH3Br和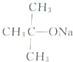 共热 共热 | D. |  和CH3OH在Al2O3存在下共热 和CH3OH在Al2O3存在下共热 |
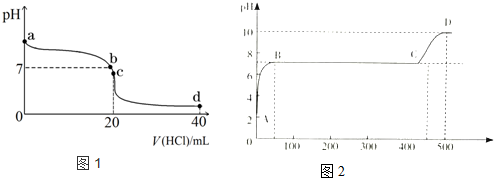
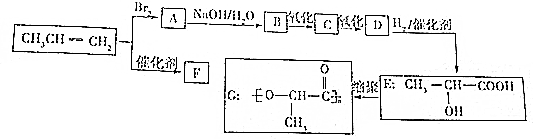
 .
.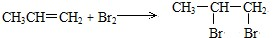 ,反应类型:加成反应;
,反应类型:加成反应;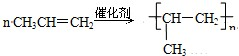 ,反应类型:加聚反应.
,反应类型:加聚反应.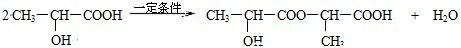 .
.