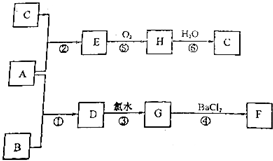
题目内容
9.将用砂纸打磨过的铝片浸入硝酸汞溶液中,过一会取出,发现铝片上长出了“白毛”;用棉花把铝片身上的“毛”擦掉之后,它又会重新长出来.这里的“毛”可能是( )| A. | 汞 | B. | 氧化汞 | C. | 氧化铝 | D. | 硝酸铝 |
分析 铝打磨后,表面的氧化物保护膜被去除,金属暴露出来,此时放入硝酸汞溶液中,则在表面发生置换反应,生成金属汞;汞能与铝结合成合金(铝汞齐),在铝汞齐表面的铝没有氧化铝保护膜的保护,很快被空气中的氧气氧化变成了白色固体氧化铝,由此分析解答.
解答 解:铝打磨后,表面的氧化物保护膜被去除,金属暴露出来,此时放入硝酸汞溶液中,则在表面发生置换反应,生成金属汞;汞能与铝结合成合金(铝汞齐),在铝汞齐表面的铝没有氧化铝保护膜的保护,很快被空气中的氧气氧化变成了白色固体氧化铝,随着铝汞齐表面的铝因氧化而减少,铝箔上的铝会不断溶解进入铝汞齐,并继续在表面被氧化,生成白色的氧化铝,最终形成“毛刷”,所以这里的“毛”可能是氧化铝,故选:C.
点评 本题考查了铝的化学性质应用,此题是结合实验对铝与汞性质的考查,解题的关键是掌握性质与现象的关系,属基础性知识考查题.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
19.某探究性学习小组设计如图1所示装置分别进行如下探究实验,请回答下列问题:
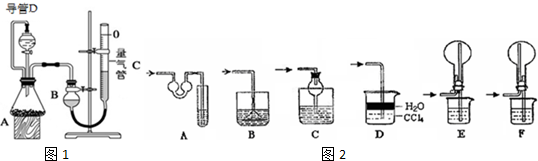
(1)实验I通过收集并测量NO气体的体积来探究铜样品的纯度,有的同学认为该实验设计不可行,主要原因是NO会与装置中空气反应,生成NO2溶于水,使测得的NO气体体积不准;
(2)实验Ⅱ中量气管中的液体最好是C(填字母编号,下同)
A.NaOH溶液 B.氨水 C.煤油 D.氯化铵溶液
实验剩余的NH3需吸收处理,以下各种尾气吸收装置如图2中,不能防止倒吸的是BE;
(3)①写出实验Ⅲ中涉及的离子反应方程式2Al+2H2O+2OH-=2AlO2-+3H2↑;
②反应前,先对量气管进行第一次读数.读数时,应注意的操作是保持装置B与装置C液面相平,并使视线与凹液面最低处相平;反应后,待装置温度冷却到室温时,再对量气管进行第二次读数.实验前,如拆去导管D,测得的气体体积将偏大(填“偏大”、“偏小”、或“无影响”).
③实验Ⅲ在25℃、1.01×105Pa条件下获得以下数据:
根据上述数据,计算出镁铝合金中铝的质量分数为26.9%.
| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、足量NaOH溶液 | H2 | H2O |

(1)实验I通过收集并测量NO气体的体积来探究铜样品的纯度,有的同学认为该实验设计不可行,主要原因是NO会与装置中空气反应,生成NO2溶于水,使测得的NO气体体积不准;
(2)实验Ⅱ中量气管中的液体最好是C(填字母编号,下同)
A.NaOH溶液 B.氨水 C.煤油 D.氯化铵溶液
实验剩余的NH3需吸收处理,以下各种尾气吸收装置如图2中,不能防止倒吸的是BE;
(3)①写出实验Ⅲ中涉及的离子反应方程式2Al+2H2O+2OH-=2AlO2-+3H2↑;
②反应前,先对量气管进行第一次读数.读数时,应注意的操作是保持装置B与装置C液面相平,并使视线与凹液面最低处相平;反应后,待装置温度冷却到室温时,再对量气管进行第二次读数.实验前,如拆去导管D,测得的气体体积将偏大(填“偏大”、“偏小”、或“无影响”).
③实验Ⅲ在25℃、1.01×105Pa条件下获得以下数据:
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 376.6mL |
| ② | 1.0g | 10.0mL | 364.7mL |
| ③ | 1.0g | 10.0mL | 377.0mL |
20.必须加入氧化剂才能实现的变化是( )
| A. | KClO3→O2 | B. | CO2→CO | C. | Fe→Fe3O4 | D. | CuO→CuSO4 |
17.下列实验装置图所示的实验操作,正确的是( )
| A. | 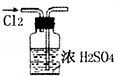 干燥Cl2 | |
| B. |  配制90ml 0.1mol•L-1硫酸溶液 | |
| C. |  分离沸点相差较大的互溶液体混合物 | |
| D. |  分离互不相溶的两种液体 |
1.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 39g苯中含有C═C键数为1.5NA | |
| B. | 0.5molFeBr2与标准状况下33.6L氯气反应时转移电子数为3NA | |
| C. | 1L0.5mol•L-1的NaClO溶液中含有的ClO-离子数为0.5NA | |
| D. | 常温常压下,14g由C2H4和C3H6组成的混合气体中含有的原子总数为3NA |
6.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度 为700℃
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数 K等于1.0(填“大于”“小于”或“等于”).
(5)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积,平衡不移动(填“向正反应方向”“向逆反应方向”或“不”).
(6)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,则此时上述反应的平衡移动方向为逆反应方向(填“正反应方向”“逆反应方向”或“不移动”)
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度 为700℃
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数 K等于1.0(填“大于”“小于”或“等于”).
(5)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积,平衡不移动(填“向正反应方向”“向逆反应方向”或“不”).
(6)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,则此时上述反应的平衡移动方向为逆反应方向(填“正反应方向”“逆反应方向”或“不移动”)