题目内容
已知25℃时,电离常数K1(H 2CO3)>K(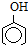 )>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(
)>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(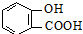 )与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )
)与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )
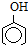 )>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(
)>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(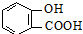 )与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )
)与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )A、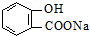 |
| B、NaHCO3 |
C、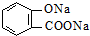 |
| D、H2O |
考点:有机物的结构和性质,有机物分子中的官能团及其结构
专题:有机物的化学性质及推断
分析:苯甲酸酸性比碳酸强,水杨酸(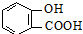 )与碳酸钠溶液反应生成CO2的同时,-COOH与碳酸钠反应生成羧酸钠、水、二氧化碳;酚-OH与碳酸钠反应生成酚钠和碳酸氢钠,结合量不同、酸性强弱可知产物可能不同,以此来解答.
)与碳酸钠溶液反应生成CO2的同时,-COOH与碳酸钠反应生成羧酸钠、水、二氧化碳;酚-OH与碳酸钠反应生成酚钠和碳酸氢钠,结合量不同、酸性强弱可知产物可能不同,以此来解答.
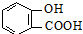 )与碳酸钠溶液反应生成CO2的同时,-COOH与碳酸钠反应生成羧酸钠、水、二氧化碳;酚-OH与碳酸钠反应生成酚钠和碳酸氢钠,结合量不同、酸性强弱可知产物可能不同,以此来解答.
)与碳酸钠溶液反应生成CO2的同时,-COOH与碳酸钠反应生成羧酸钠、水、二氧化碳;酚-OH与碳酸钠反应生成酚钠和碳酸氢钠,结合量不同、酸性强弱可知产物可能不同,以此来解答.解答:
解:苯甲酸酸性比碳酸强,水杨酸(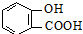 )与碳酸钠溶液反应生成CO2的同时,-COOH与碳酸钠反应生成羧酸钠、水、二氧化碳;酚-OH与碳酸钠反应生成酚钠和碳酸氢钠,若碳酸钠足量,酚-OH、-COOH均反应,生成
)与碳酸钠溶液反应生成CO2的同时,-COOH与碳酸钠反应生成羧酸钠、水、二氧化碳;酚-OH与碳酸钠反应生成酚钠和碳酸氢钠,若碳酸钠足量,酚-OH、-COOH均反应,生成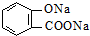 、NaHCO3、H2O,由信息可知,与碳酸钠溶液反应生成CO2的同时,酸过量,不能生成的物质是
、NaHCO3、H2O,由信息可知,与碳酸钠溶液反应生成CO2的同时,酸过量,不能生成的物质是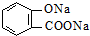 ,
,
故选C.
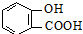 )与碳酸钠溶液反应生成CO2的同时,-COOH与碳酸钠反应生成羧酸钠、水、二氧化碳;酚-OH与碳酸钠反应生成酚钠和碳酸氢钠,若碳酸钠足量,酚-OH、-COOH均反应,生成
)与碳酸钠溶液反应生成CO2的同时,-COOH与碳酸钠反应生成羧酸钠、水、二氧化碳;酚-OH与碳酸钠反应生成酚钠和碳酸氢钠,若碳酸钠足量,酚-OH、-COOH均反应,生成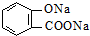 、NaHCO3、H2O,由信息可知,与碳酸钠溶液反应生成CO2的同时,酸过量,不能生成的物质是
、NaHCO3、H2O,由信息可知,与碳酸钠溶液反应生成CO2的同时,酸过量,不能生成的物质是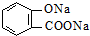 ,
,故选C.
点评:本题考查有机物的结构与性质,为高频考点,把握酸性强弱及羧酸、苯酚的性质为解答的关键,侧重分析及综合应用能力的考查,题目难度不大.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、78 g Na2O2与足量水反应中电子转移了0.2NA |
| B、1 mol甲基中含有7 NA 个电子 |
| C、62 g白磷中含P-P键为3 NA |
| D、1 mol氖气含有的原子数为2 NA |
下列方程式中,正确的是( )
| A、S2-水解反应:S2-+2H2O?H2S+2OH- |
| B、氯气与氯化亚铁溶液反应:Cl2+2Fe2+═2Fe3++2Cl- |
| C、H2CO3在水中电离:H2CO3?2H++CO32- |
| D、氢氧化钠溶液吸收过量的二氧化碳:2NaOH+CO2═Na2CO3+2H2O |
利用如图所示装置,能完成实验室制取气体的是( )


| A、用①③制取氧气 |
| B、用②③制取二氧化碳 |
| C、用②④制取氧气 |
| D、用①⑤制取二氧化碳 |
化学与生活息息相关,下列说法正确的是( )
| A、HClO是弱酸,所以NaClO是弱电解质 |
| B、95℃纯水的pH<7,说明加热可导致水呈酸性 |
| C、放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关 |
| D、自来水水阀生锈主要是化学腐蚀所致 |
将3mol 甲烷与氯气发生取代反应,待反应完全后测知四种取代物的物质的量相同,测消耗的氯气有( )
| A、2mol | B、10mol |
| C、7.5mol | D、6mol |
下列一定能说明酸HX是弱电解质的是( )
①常温下NaX溶液的pH大于7;
②HX溶液做导电实验,灯泡很暗;
③HX不与NaCl反应;
④0.1mol/L的HX溶液的pH=2;
⑤HX具有很强的挥发性;
⑥pH=1的HX加水稀释成10倍后,pH=1.5.
①常温下NaX溶液的pH大于7;
②HX溶液做导电实验,灯泡很暗;
③HX不与NaCl反应;
④0.1mol/L的HX溶液的pH=2;
⑤HX具有很强的挥发性;
⑥pH=1的HX加水稀释成10倍后,pH=1.5.
| A、②③⑤ | B、①④⑥ |
| C、①②④⑥ | D、①②③④⑤⑥ |
下列说法正确的是( )
| A、SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆 |
| B、由于Fe可被浓H2SO4氧化,因此常温下不能用钢瓶贮浓H2SO4 |
| C、镁铝合金的熔点比镁和铝都高 |
| D、不能用氨水鉴别Al3+﹑Mg2+﹑Ag+ |



