题目内容
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、78 g Na2O2与足量水反应中电子转移了0.2NA |
| B、1 mol甲基中含有7 NA 个电子 |
| C、62 g白磷中含P-P键为3 NA |
| D、1 mol氖气含有的原子数为2 NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.过氧化钠中氧元素的化合价为-1价,根据过氧化钠与水反应生成氧气的物质的量计算出转移的电子数;
B.甲基中含有9个电子,1mol甲基中含有9mol电子;
C.白磷是正四面体型结构,分子中含有6个P-P共价键,据此判断62g白磷分子中含有的P-P键数目;
D.稀有气体为单原子分子,1mol氖气中含有1mol氖原子.
B.甲基中含有9个电子,1mol甲基中含有9mol电子;
C.白磷是正四面体型结构,分子中含有6个P-P共价键,据此判断62g白磷分子中含有的P-P键数目;
D.稀有气体为单原子分子,1mol氖气中含有1mol氖原子.
解答:
解:A.78g过氧化钠的物质的量为1mol,1mol过氧化钠与足量水反应生成0.5mol氧气,注意了1mol电子,电子转移了NA,故A错误;
B.甲基的电子式为: ,1mol甲基中含有9mol电子,含有9NA 个电子,故B错误;
,1mol甲基中含有9mol电子,含有9NA 个电子,故B错误;
C.62 g白磷(分子式为P4)的物质的量是0.5mol,白磷分子中含有6个P-P共价键,0.5mol白磷分子中含有3molP-P键,所以分子中含有P-P共价键3NA,故C正确;
D.1mol氖气中含有1mol氖原子,含有的原子数为NA,故D错误;
故选C.
B.甲基的电子式为:
 ,1mol甲基中含有9mol电子,含有9NA 个电子,故B错误;
,1mol甲基中含有9mol电子,含有9NA 个电子,故B错误;C.62 g白磷(分子式为P4)的物质的量是0.5mol,白磷分子中含有6个P-P共价键,0.5mol白磷分子中含有3molP-P键,所以分子中含有P-P共价键3NA,故C正确;
D.1mol氖气中含有1mol氖原子,含有的原子数为NA,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确稀有气体为单原子分子,选项B为易错点,注意甲基与甲烷、羟基与氢氧根离子的关系.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
下列解释实验现象的反应方程式正确的是( )
| A、向Na2CO3溶液中滴入酚酞试液,溶液变红CO32-+2H2O?H2CO3+2OH- |
| B、向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgC1+S2-=Ag2S↓+2C1- |
| C、铜器在潮湿的环境中表面生成一层“铜绿”:Cu+O2+CO2=CuCO3 |
| D、向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
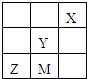 四种非金属主族元素M、X、Y、Z在周期表中相对位置如图,下列判断不正确的是( )
四种非金属主族元素M、X、Y、Z在周期表中相对位置如图,下列判断不正确的是( )| A、Z的氢化物中中心原子的杂化方式为sp3 |
| B、Z原子的第一电离能小于M原子的第一电离能 |
| C、四种元素全部位于p区 |
| D、M、Y、Z最高价氧化物对应水化物的酸性从强到弱的顺序为:Y>M>Z |
下列事实或现象不能用平衡移动原理来解释的是( )
| A、夏天冰镇啤酒倒入杯中,泛起大量泡沫 |
| B、氯水保存要在低温暗处 |
| C、工业上制氨要用高温,催化剂 |
| D、为提高SO2转化成SO3的量,常通入过量氧气 |
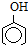 )>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(
)>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(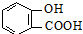 )与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )
)与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )