题目内容
将3mol 甲烷与氯气发生取代反应,待反应完全后测知四种取代物的物质的量相同,测消耗的氯气有( )
| A、2mol | B、10mol |
| C、7.5mol | D、6mol |
考点:化学方程式的有关计算,取代反应与加成反应,甲烷的化学性质
专题:计算题
分析:根据四种取代物的物质的量相等结合碳原子守恒计算取代物的物质的量,再根据被取代的氢原子和氯气分子之间的关系式计算消耗氯气的物质的量.
解答:
解:1molCH4与Cl2发生取代反应,欲得到四种取代物的物质的量相等,则生成CH3Cl、CH2Cl2、CHCl3、CCl4各为0.25mol,3mol甲烷完全与氯气发生取代反应,若生成相同物质的量的四种取代物,所以每种取代物的物质的量是0.75mol,甲烷和氯气的取代反应中,被取代的氢原子的物质的量与氯气的物质的量相等,
所以生成0.75mol一氯甲烷需要氯气0.75mol氯气,
生成0.75mol二氯甲烷需要氯气1.5mol,
生成0.75mol三氯甲烷需要氯气2.25mol氯气,
生成0.75mol四氯化碳需要氯气3mol,
所以总共消耗氯气的物质的量=0.75mol+1.5mol+2.25mol+3mol=7.5mol,
故选C.
所以生成0.75mol一氯甲烷需要氯气0.75mol氯气,
生成0.75mol二氯甲烷需要氯气1.5mol,
生成0.75mol三氯甲烷需要氯气2.25mol氯气,
生成0.75mol四氯化碳需要氯气3mol,
所以总共消耗氯气的物质的量=0.75mol+1.5mol+2.25mol+3mol=7.5mol,
故选C.
点评:本题考查了甲烷的取代反应,明确甲烷的取代反应中被取代的氢原子和氯气之间的关系是解本题的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
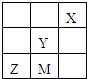 四种非金属主族元素M、X、Y、Z在周期表中相对位置如图,下列判断不正确的是( )
四种非金属主族元素M、X、Y、Z在周期表中相对位置如图,下列判断不正确的是( )| A、Z的氢化物中中心原子的杂化方式为sp3 |
| B、Z原子的第一电离能小于M原子的第一电离能 |
| C、四种元素全部位于p区 |
| D、M、Y、Z最高价氧化物对应水化物的酸性从强到弱的顺序为:Y>M>Z |
有关碰撞理论,下列说法中不正确的是( )
| A、具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应 |
| B、增大反应物浓度,单位体积内活化分子数增多,有效碰撞几率增大,反应速率增大 |
| C、升高温度,活化分子百分数增大,有效碰撞的几率增大,反应速率增大 |
| D、正催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞的几率增大,反应速率增大 |
萃取水中的溴,不可以选择的萃取剂是( )
| A、汽油 | B、酒精 | C、苯 | D、四氯化碳 |
已知25℃时,电离常数K1(H 2CO3)>K(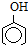 )>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(
)>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(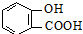 )与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )
)与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )
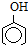 )>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(
)>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(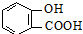 )与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )
)与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )A、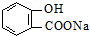 |
| B、NaHCO3 |
C、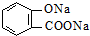 |
| D、H2O |
下列叙述正确的是( )
| A、石油裂化主要得到乙烯 |
| B、石油分馏是化学变化,可得到汽油、煤油等 |
| C、煤的干馏主要得到煤焦油、焦炉气、焦炭、粗氨水 |
| D、煤的气化和液化是物理变化,是使煤变成清洁能源的有效途径 |
下列关于油脂的叙述不正确的是( )
| A、油脂属于酯类,是高级脂肪酸的甘油酯 |
| B、油脂没有固定的熔、沸点 |
| C、油脂在不同条件下水解都能生成甘油 |
| D、油脂都不能使溴水褪色 |
要配制浓度约为2mol?L-1NaOH溶液100mL,下面操作正确的是( )
| A、称取8gNaOH固体,放入100mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 |
| B、称取8gNaOH固体,放入100mL量筒中,边搅拌,便慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL |
| C、称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加水到刻度,盖好瓶塞,反复摇匀 |
| D、用100mL量筒量取40mL5mol?L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、常温常压下,17g甲基(-14CH3)所含的电子数为10NA |
| B、pH=1的稀硫酸中含有的H+数为0.1NA |
| C、7.8g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA |
| D、3mol NO2和足量H2O反应,转移NA个电子 |