题目内容
化学与生活息息相关,下列说法正确的是( )
| A、HClO是弱酸,所以NaClO是弱电解质 |
| B、95℃纯水的pH<7,说明加热可导致水呈酸性 |
| C、放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关 |
| D、自来水水阀生锈主要是化学腐蚀所致 |
考点:弱电解质在水溶液中的电离平衡,金属的电化学腐蚀与防护,化学反应速率的影响因素,水的电离
专题:基本概念与基本理论,化学应用
分析:A.HClO是弱电解质,但NaClO是强电解质;
B.水是弱电解质,升高温度促进水电离,但水仍然呈中性;
C.温度越低反应速率越小;
D.自来水水阀生锈主要是钢铁在中性条件下发生吸氧腐蚀,所以为电化学腐蚀所致.
B.水是弱电解质,升高温度促进水电离,但水仍然呈中性;
C.温度越低反应速率越小;
D.自来水水阀生锈主要是钢铁在中性条件下发生吸氧腐蚀,所以为电化学腐蚀所致.
解答:
解:A.HClO是弱电解质,但NaClO在水溶液里或熔融状态下完全电离,所以NaClO属于强电解质,故A错误;
B.纯水加热电离度增大,但仍然是中性的,故B错误;
C.温度反应是放热反应还是吸热反应,降低温度,反应速率都减小,所以放在冰箱中的食品保质期较长,故C正确;
D.自来水水阀长期处于潮湿的环境中主要发生的是吸氧腐蚀,属于电化腐蚀,故D错误;
故选C.
B.纯水加热电离度增大,但仍然是中性的,故B错误;
C.温度反应是放热反应还是吸热反应,降低温度,反应速率都减小,所以放在冰箱中的食品保质期较长,故C正确;
D.自来水水阀长期处于潮湿的环境中主要发生的是吸氧腐蚀,属于电化腐蚀,故D错误;
故选C.
点评:本题考查化学与生活,涉及强弱电解质的判断、溶液酸碱性判断、金属腐蚀与防护、温度与反应速率关系等知识点,利用基本概念、基本理论即可解答,注意溶液酸碱性不能根据pH大小判断,要根据溶液中氢离子和氢氧根离子浓度相对大小判断,为易错点.

练习册系列答案
相关题目
下列解释实验现象的反应方程式正确的是( )
| A、向Na2CO3溶液中滴入酚酞试液,溶液变红CO32-+2H2O?H2CO3+2OH- |
| B、向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgC1+S2-=Ag2S↓+2C1- |
| C、铜器在潮湿的环境中表面生成一层“铜绿”:Cu+O2+CO2=CuCO3 |
| D、向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
已知w g物质A在O2中充分燃烧后,产物被足量的Na2O2完全吸收后,Na2O2固体增重w g,当A为H2或CO时,上述说法成立.据此推断A不可能是下列物质中的( )
| A、H2和CO的混合气 |
| B、D2 |
| C、甲醇 |
| D、乙醇 |
同温同压下,在四支相同体积的试管中分别充有等体积混合的两种气体,它们是①NO和NO2 ②NO2和O2③NH3和N2 ④NO和O2.现将4支试管均倒置于水槽里的水中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3、V4,则下列关系正确的是( )
| A、V1>V2>V3>V4 |
| B、V1>V3>V2>V4 |
| C、V2>V4>V3>V1 |
| D、V3>V1>V4>V2 |
下列说法正确的是( )
| A、pH=2和pH=1的硝酸中c(H+)之比为10:1 | ||
| B、一元酸与一元碱恰好完全反应后的溶液中一定存在c(H+)=c(OH-) | ||
C、KAl(SO4)2溶液中离子浓度的大小顺序为c(SO
| ||
| D、常温下,将pH均为12的氨水和NaOH溶液分别加水稀释100倍后,NaOH溶液的pH较大 |
已知25℃时,电离常数K1(H 2CO3)>K(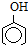 )>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(
)>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(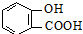 )与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )
)与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )
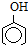 )>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(
)>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(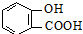 )与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )
)与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )A、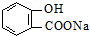 |
| B、NaHCO3 |
C、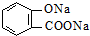 |
| D、H2O |
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.下列说法正确的是( )| A、元素Q的非金属性比R的强 |
| B、离子半径的大小顺序:r(Tm+)>r(Wn-) |
| C、元素Q的氧化物均为酸性氧化物 |
| D、元素T与元素R的最高正价之和等于8 |
下列实验不能达到目的是( )
A、 测定一定时间内生成H2的反应速率 |
B、 用CO2作喷泉实验 |
C、 验证NH3易溶于水实验 |
D、 测定酸碱中和反应的中和热 |
下列说法不正确的是( )
| A、利用丁达尔现象可以鉴别胶体和溶液 |
| B、在豆浆里加入盐卤做豆腐与胶体的聚沉有关 |
| C、胶体与溶液的分离可用渗析的方法 |
| D、KCl溶液、淀粉溶液和纯水都属于分散系 |