题目内容
下列一定能说明酸HX是弱电解质的是( )
①常温下NaX溶液的pH大于7;
②HX溶液做导电实验,灯泡很暗;
③HX不与NaCl反应;
④0.1mol/L的HX溶液的pH=2;
⑤HX具有很强的挥发性;
⑥pH=1的HX加水稀释成10倍后,pH=1.5.
①常温下NaX溶液的pH大于7;
②HX溶液做导电实验,灯泡很暗;
③HX不与NaCl反应;
④0.1mol/L的HX溶液的pH=2;
⑤HX具有很强的挥发性;
⑥pH=1的HX加水稀释成10倍后,pH=1.5.
| A、②③⑤ | B、①④⑥ |
| C、①②④⑥ | D、①②③④⑤⑥ |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:要证明醋酸为弱酸,可证明存在电离平衡、不能完全电离或从对应的强碱盐溶液呈碱性的角度,以此解答该题.
解答:
解:①常温下NaX溶液的pH大于7,说明NaX属于强碱弱酸盐,则HX为弱电解质,故正确;
②溶液的导电性与溶液中带电离子的浓度有关,HX溶液做导电实验,灯泡很暗,说明溶液中离子浓度很小,但是不能说明HX是否完全电离,所以不能说明HX为弱电解质,故错误;
③HX不与NaCl反应,不能说明HX为弱电解质,强酸HBr与NaCl也不反应,故错误;
④0.1mol/L的HX溶液的pH=2,即溶液中氢离子浓度为0.01mol/L,说明HX没有完全电离,为弱电解质,故正确;
⑤强酸也有挥发性,HX具有很强的挥发性,不能说明HX为弱电解质,故错误;
⑥pH=1的HX加水稀释成10倍后,若为强电解质,则pH=2,而实际上pH=1.5,说明加水稀释促进了HX的电离,则HX为弱酸,所以能说明HX为弱电解质,故正确.
所以一定能说明酸HX是弱电解质的是①④⑥;
故选B.
②溶液的导电性与溶液中带电离子的浓度有关,HX溶液做导电实验,灯泡很暗,说明溶液中离子浓度很小,但是不能说明HX是否完全电离,所以不能说明HX为弱电解质,故错误;
③HX不与NaCl反应,不能说明HX为弱电解质,强酸HBr与NaCl也不反应,故错误;
④0.1mol/L的HX溶液的pH=2,即溶液中氢离子浓度为0.01mol/L,说明HX没有完全电离,为弱电解质,故正确;
⑤强酸也有挥发性,HX具有很强的挥发性,不能说明HX为弱电解质,故错误;
⑥pH=1的HX加水稀释成10倍后,若为强电解质,则pH=2,而实际上pH=1.5,说明加水稀释促进了HX的电离,则HX为弱酸,所以能说明HX为弱电解质,故正确.
所以一定能说明酸HX是弱电解质的是①④⑥;
故选B.
点评:本题考查弱电解质的判断,明确弱电解质的性质是解答本题的关键,注意常用的方法是利用电离的不完全性、测定盐溶液的pH、做对比实验等来判断弱电解质,题目难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
下列事实或现象不能用平衡移动原理来解释的是( )
| A、夏天冰镇啤酒倒入杯中,泛起大量泡沫 |
| B、氯水保存要在低温暗处 |
| C、工业上制氨要用高温,催化剂 |
| D、为提高SO2转化成SO3的量,常通入过量氧气 |
同温同压下,在四支相同体积的试管中分别充有等体积混合的两种气体,它们是①NO和NO2 ②NO2和O2③NH3和N2 ④NO和O2.现将4支试管均倒置于水槽里的水中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3、V4,则下列关系正确的是( )
| A、V1>V2>V3>V4 |
| B、V1>V3>V2>V4 |
| C、V2>V4>V3>V1 |
| D、V3>V1>V4>V2 |
已知25℃时,电离常数K1(H 2CO3)>K(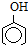 )>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(
)>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(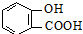 )与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )
)与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )
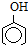 )>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(
)>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(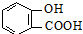 )与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )
)与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )A、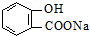 |
| B、NaHCO3 |
C、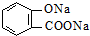 |
| D、H2O |
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.下列说法正确的是( )| A、元素Q的非金属性比R的强 |
| B、离子半径的大小顺序:r(Tm+)>r(Wn-) |
| C、元素Q的氧化物均为酸性氧化物 |
| D、元素T与元素R的最高正价之和等于8 |
下列关于油脂的叙述不正确的是( )
| A、油脂属于酯类,是高级脂肪酸的甘油酯 |
| B、油脂没有固定的熔、沸点 |
| C、油脂在不同条件下水解都能生成甘油 |
| D、油脂都不能使溴水褪色 |
下列实验不能达到目的是( )
A、 测定一定时间内生成H2的反应速率 |
B、 用CO2作喷泉实验 |
C、 验证NH3易溶于水实验 |
D、 测定酸碱中和反应的中和热 |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、在1 L 0.2 mol?L-1的Na2CO3溶液中含有CO32-的数目为0.2NA |
| B、0.1 mol Fe参加氧化还原反应,转移的电子数目一定是0.3 NA |
| C、15.6 g Na2O2 与过量CO2反应时,转移的电子数为0.2NA |
| D、1 mol Na2O2中含有的阴离子数目为2NA |
铁是人体的重要营养元素,铁在人体内的主要功能是以血红蛋白(含低价铁)的形式参加氧的转运、交换、和组织呼吸过程,以及在体内用于生产供给生命活动需要的细胞能量ATP.人体正常的血红蛋白应该含Fe2+.若误食亚硝酸盐,则导致血红蛋白中Fe2+转化成Fe3+而中毒,服用维生素C可解毒.下列叙述正确的是( )
| A、亚硝酸盐是还原剂 |
| B、维生素C是氧化剂 |
| C、维生素C将Fe3+还原为Fe2+ |
| D、亚硝酸盐被氧化 |