题目内容
下列说法正确的是( )
| A、SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆 |
| B、由于Fe可被浓H2SO4氧化,因此常温下不能用钢瓶贮浓H2SO4 |
| C、镁铝合金的熔点比镁和铝都高 |
| D、不能用氨水鉴别Al3+﹑Mg2+﹑Ag+ |
考点:硅和二氧化硅,合金的概念及其重要应用,铁的化学性质,物质的检验和鉴别的基本方法选择及应用
专题:元素及其化合物
分析:A.光导纤维制造光缆是利用光的全反射原理;
B.常温下,铁和浓硫酸发生钝化现象;
C.合金熔点低于任一成分熔点;
D.氨水和Al3+﹑Mg2+都生成白色沉淀.
B.常温下,铁和浓硫酸发生钝化现象;
C.合金熔点低于任一成分熔点;
D.氨水和Al3+﹑Mg2+都生成白色沉淀.
解答:
解:A.光SiO2制成的玻璃纤维,由于光的全反射而被用于制造通讯光缆,故A错误;
B.常温下,铁和浓硫酸发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,所以常温下能用钢瓶贮浓H2SO4,故B错误;
C.合金熔点低于任一成分熔点,所以镁铝合金的熔点比镁和铝都低,故C错误;
D.氨水和Al3+﹑Mg2+都生成白色沉淀,离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+、Mg2++2NH3.H2O=Mg(OH)2↓+2NH4+,二者反应现象相同,不能鉴别;氨水和银离子反应先生成沉淀后生成络合物,故D正确;
故选D.
B.常温下,铁和浓硫酸发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,所以常温下能用钢瓶贮浓H2SO4,故B错误;
C.合金熔点低于任一成分熔点,所以镁铝合金的熔点比镁和铝都低,故C错误;
D.氨水和Al3+﹑Mg2+都生成白色沉淀,离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+、Mg2++2NH3.H2O=Mg(OH)2↓+2NH4+,二者反应现象相同,不能鉴别;氨水和银离子反应先生成沉淀后生成络合物,故D正确;
故选D.
点评:本题考查物质的用途、离子鉴别等知识点,明确物质性质、物质之间的反应即可解答,易错选项是D,注意氢氧化铝不溶于弱碱,知道氨水和硝酸银溶液反应现象,题目难度不大.

练习册系列答案
相关题目
已知25℃时,电离常数K1(H 2CO3)>K(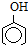 )>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(
)>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(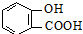 )与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )
)与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )
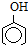 )>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(
)>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(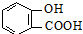 )与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )
)与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )A、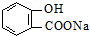 |
| B、NaHCO3 |
C、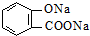 |
| D、H2O |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、在1 L 0.2 mol?L-1的Na2CO3溶液中含有CO32-的数目为0.2NA |
| B、0.1 mol Fe参加氧化还原反应,转移的电子数目一定是0.3 NA |
| C、15.6 g Na2O2 与过量CO2反应时,转移的电子数为0.2NA |
| D、1 mol Na2O2中含有的阴离子数目为2NA |
元素周期律和元素周期表是学习化学的重要工具,下列说法正确的是( )
| A、Li、Mg、Al、Sn原子的最外层电子数依次增加,故失去电子的能力越来越强 |
| B、钚(Pu)属于过渡元素,能跟氟形成PuF6,据此可推测Pu原子最外层有6个电子 |
| C、HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱 |
| D、14C与14N质量数相同,可以互称为同位素 |
下列说法不正确的是( )
| A、利用丁达尔现象可以鉴别胶体和溶液 |
| B、在豆浆里加入盐卤做豆腐与胶体的聚沉有关 |
| C、胶体与溶液的分离可用渗析的方法 |
| D、KCl溶液、淀粉溶液和纯水都属于分散系 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、常温常压下,17g甲基(-14CH3)所含的电子数为10NA |
| B、pH=1的稀硫酸中含有的H+数为0.1NA |
| C、7.8g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA |
| D、3mol NO2和足量H2O反应,转移NA个电子 |
铁是人体的重要营养元素,铁在人体内的主要功能是以血红蛋白(含低价铁)的形式参加氧的转运、交换、和组织呼吸过程,以及在体内用于生产供给生命活动需要的细胞能量ATP.人体正常的血红蛋白应该含Fe2+.若误食亚硝酸盐,则导致血红蛋白中Fe2+转化成Fe3+而中毒,服用维生素C可解毒.下列叙述正确的是( )
| A、亚硝酸盐是还原剂 |
| B、维生素C是氧化剂 |
| C、维生素C将Fe3+还原为Fe2+ |
| D、亚硝酸盐被氧化 |
可以说明HCOOH是弱酸的事实是( )
| A、甲酸与水能以任意比混溶 |
| B、甲酸能与Na2CO3溶液反应,生成CO2气体 |
| C、1mol/L的HCOOH水溶液能使紫色石蕊试液变红 |
| D、1mol/L的HCOONa溶液的pH约为8.5 |
下列说法中,不正确的是( )
| A、大多数有机物难溶于水,易溶于汽油、苯等有机溶剂 |
| B、有机物的熔点低 |
| C、有机物都是非电解质,不易导电 |
| D、有机物的化学反应比较复杂,一般较慢,且常伴有副反应发生 |