题目内容
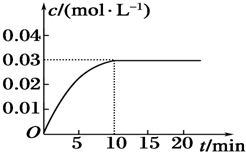
8.已知2SO2(g)+O2(g)?2SO3(g)△H<0,温度一定,体积为1L的密闭容器中,投入2mol SO2和1molO2,2min反应达平衡时,容器中有1.2mol SO3,放出热量118.2kJ,试计算:(要求写计算过程)(1)写出该反应的热化学方程式; (2)该反应中SO2的转化率是多少?
(3)计算该温度下的平衡常数K(保留两位小数);
(4)容器内反应前与平衡时的压强之比(最简整数比).
分析 2min反应达平衡时,容器中有1.2mol SO3,放出热量118.2kJ,生成2mol三氧化硫放热为197KJ,以此可计算反应热,并书写热化学方程式,
2SO2(g)+O2(g)?2SO3(g)
起始量(mol) 2 1 0
变化量(mol) 1.2 0.6 1.2
平衡量(mol) 0.8 0.4 1.2
以此解答该题.
解答 解:(1)2min反应达平衡时,容器中有1.2mol SO3,放出热量118.2kJ,生成2mol三氧化硫放热为197KJ,标注物质聚集状态和对应反应的焓变写出反应的化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-197KJ/mol;
答:该反应的热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-197KJ/mol;
(2)依据化学平衡三段式列式计算;
2SO2(g)+O2(g)?2SO3(g)
起始量(mol) 2 1 0
变化量(mol) 1.2 0.6 1.2
平衡量(mol) 0.8 0.4 1.2
反应中SO2的转化率=$\frac{1.2mol}{2mol}$×100%=60%;
答:反应中SO2的转化率为60%;
(3)该温度下的平衡常数K=$\frac{1.{2}^{2}}{0.{8}^{2}×0.4}$=5.63,
答:计算该温度下的平衡常数K为5.63;
(4)反应前的物质的量为3mol,反应后气体的物质的量为2.4mol,则二者压强之比为3:2.4=5:4,
答:容器内反应前与平衡时的压强之比为5:4.
点评 本题考查较为综合,综合考查学生的分析能力和计算能力,为高考常见题型,题目涉及热化学方程式书写,化学平衡计算应用,主要是平衡浓度和转化率的计算,题目难度中等.

| 选项 | X | Y | 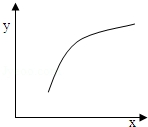 |
| A | 温度 | 容器内混合气体的密度 | |
| B | A的物质的量 | B的转化率 | |
| C | 催化剂的质量 | C的体积分数 | |
| D | 加入Ar的物质的量 | 逆反应速率 |
| A. | A | B. | B | C. | C | D. | D |
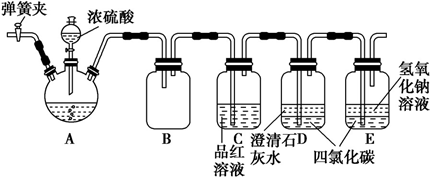
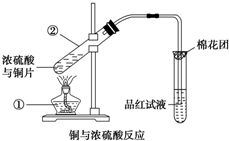 如图是铜与浓硫酸反应的实验装置图,请回答下列问题.
如图是铜与浓硫酸反应的实验装置图,请回答下列问题.