题目内容
20.已知有反应:2A(g)+B(g)$\frac{\underline{\;催化剂\;}}{\;}$3C(g);△H<0,在恒容的密闭容器中,通入A和B气体,反应达到平衡后,若仅改变图中x的值,则y随x变化趋势合理的是( )| 选项 | X | Y | 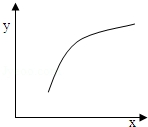 |
| A | 温度 | 容器内混合气体的密度 | |
| B | A的物质的量 | B的转化率 | |
| C | 催化剂的质量 | C的体积分数 | |
| D | 加入Ar的物质的量 | 逆反应速率 |
| A. | A | B. | B | C. | C | D. | D |
分析 反应2A(g)+B(g)$\frac{\underline{\;催化剂\;}}{\;}$3C(g);△H<0,平衡常数只随温度变化,增加B的量,促进A的转化,加入C,化学平衡逆向移动,增大压强,平衡正向移动,升高温度,化学平衡逆向移动,催化剂改变反应速率不改变化学平衡,结合图象可知一个量增大引起另一个量的增大来解答.
解答 解:A.达平衡后,升高温度,化学平衡逆向移动,反应前后气体体积、质量不变,密度始终不变,与图象不符合,故A错误;
B.达平衡后,加入A的物质的量,平衡正向移动,则B的转化率增大,与图象符合,故B正确;
C.达平衡后,再加入催化剂,改变化学反应速率,化学平衡不移动,C的体积分数不变,与图象不符合,故C错误;
D.加入惰性气体,平衡不移动,故D错误.
故选B.
点评 本题考查化学平衡的影响因素及化学平衡图象,为高频考点,侧重于学生的分析能力的考查,明确不同因素对化学平衡的影响及由图象得出一个量增大引起另一个量的增大是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
10.碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如下:
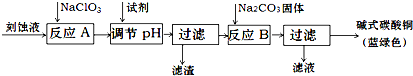
Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
(1)氯酸钠的作用是将Fe2+氧化成Fe3+并最终除去;滤渣的主要成分是Fe(OH)3(写化学式).
(2)调节反应A后溶液的pH范围应为3.2-4.2.可以选择的试剂是d(填序号).
a.氨水 b.稀硫酸 c.氢氧化钠 d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是CuO .(写化学式)
(4)过滤得到的产品洗涤时,如何判断产品已经洗净?取最后一次洗涤液,加入硝酸银和稀硝酸,无沉淀生成则表明已洗涤干净,其它合理答案也给分.
(5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀.
①若沉淀只有CuCO3,则相应的离子方程式为Cu2++CO32-=CuCO3↓
②若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
③若生成Cu(OH)2和CuCO3的混合物(即碱式盐).则说明碳酸铜于氢氧化铜的溶解度相近
(6)碱式碳酸铜组成可表示为:aCuCO3•bCu(OH)2•cH2O,现通过下列方案测定其组成.步骤如下:
①称量样品;②高温分解;③测出CO2的质量;④测出水蒸汽的质量;⑤称量CuO.
请对上述测定方案作出评价.①称量样品的质量必须知道,③测出CO2的质量④测出水蒸汽的质量⑤称量CuO的质量三个数据知道其中的任意两个即可,另一部分的数据可由样品的质量和已知两部分的质量求得..

Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
(2)调节反应A后溶液的pH范围应为3.2-4.2.可以选择的试剂是d(填序号).
a.氨水 b.稀硫酸 c.氢氧化钠 d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是CuO .(写化学式)
(4)过滤得到的产品洗涤时,如何判断产品已经洗净?取最后一次洗涤液,加入硝酸银和稀硝酸,无沉淀生成则表明已洗涤干净,其它合理答案也给分.
(5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀.
①若沉淀只有CuCO3,则相应的离子方程式为Cu2++CO32-=CuCO3↓
②若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
③若生成Cu(OH)2和CuCO3的混合物(即碱式盐).则说明碳酸铜于氢氧化铜的溶解度相近
(6)碱式碳酸铜组成可表示为:aCuCO3•bCu(OH)2•cH2O,现通过下列方案测定其组成.步骤如下:
①称量样品;②高温分解;③测出CO2的质量;④测出水蒸汽的质量;⑤称量CuO.
请对上述测定方案作出评价.①称量样品的质量必须知道,③测出CO2的质量④测出水蒸汽的质量⑤称量CuO的质量三个数据知道其中的任意两个即可,另一部分的数据可由样品的质量和已知两部分的质量求得..