题目内容
2.要降低过量Zn和一定量稀H2SO4间反应生成氢气速率,下列措施正确的是( )| A. | 加入固体硫酸钠 | B. | 滴加几滴硫酸铜溶液 | ||
| C. | 升高稀硫酸温度 | D. | 加入硫酸钠溶液 |
分析 影响化学反应速率的因素有浓度、温度、压强以及催化剂、表面积等,降低反应速率,可降低浓度、温度或减小固体表面积,以此解答该题.
解答 解:A.加入固体硫酸钠,浓度不变,反应不变,故A错误;
B.滴加几滴硫酸铜溶液,锌置换铜,形成原电池反应,反应速率增大,故B错误;
C.升高温度,反应速率增大,故C错误;
D.加入硫酸钠溶液,浓度减小,反应速率减小,故D正确.
故选D.
点评 本题考查影响化学反应速率的因素,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意常见影响化学反应速率的因素除温度、浓度、压强、催化剂之后还有表面积、溶剂、光照等因素,注意常见基础知识的积累.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
12.下列实验操作中正确的是( )
| A. | 制取溴苯:将铁屑、溴水、苯混合加热 | |
| B. | 实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸 | |
| C. | 除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏 | |
| D. | 除去甲烷中混有的少量乙烯:将混合气体通入酸性KMnO4溶液中洗气 |
13.下列实验操作中正确的是( )
| A. | 分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出 | |
| B. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| C. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
10. 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
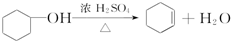
可能用到的有关数据如下:
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是圆底烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B.
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是干燥.
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶
D.球形冷凝管 E.接收器
(6)本实验所得到的环己烯产率是61%.
 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
可能用到的有关数据如下:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是圆底烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B.
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是干燥.
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶
D.球形冷凝管 E.接收器
(6)本实验所得到的环己烯产率是61%.
17.已知某无色溶液中含有SO42-、Cl-、NO3-三种阴离子,则溶液中大量存在的阳离子是( )
| A. | Ba2+ | B. | Fe3+ | C. | Ag+ | D. | Mg2+ |
7.由Al3+→Al(OH)3→AlO${\;}_{2}^{-}$→___→Al3+系列变化中,___中应填写的是( )
| A. | Al(OH)3 | B. | AlCl3 | C. | HCl | D. | NaOH |
14.下列说法正确的是( )
| A. | 1L水中溶解了58.5g NaCl,该溶液的物质的量浓度为1mol/L | |
| B. | V L Fe2(SO4)3溶液中含a g SO42-,取此溶液0.5VL用水稀释成2V L,则稀释后溶液的c(Fe3+)为$\frac{a}{4V}$ mol/L | |
| C. | 实验室需240mL2mol/L的CuSO4溶液,配置时应称125.0gCuSO4•5H2O | |
| D. | 10mL质量分数为98%的H2SO4,用水稀释至100mL,质量分数变为9.8% |
17.与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示).下表是某温度下几种常见弱酸的电离平衡常数:
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3-、H3PO4、H2PO4-、HPO42-都看作是酸,则它们酸性最强的是H3PO4(填化学式,下同),最弱的是HPO42-.
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为CO2+ClO-+H2O═HClO+HCO3-,1.2mol•L-1的NaClO溶液pH=10.8(已知:lg2=0.3).
(3)求出该温度下,0.10mol•L-1的CH3COOH溶液中的c(H+)=1.4×10-3mol•L-1.
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| HClO | CHl0?ClO-+H+ | 3.0×10-8 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.4×10-7 K2=5.61×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++HPO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
(1)若把CH3COOH、HClO、H2CO3、HCO3-、H3PO4、H2PO4-、HPO42-都看作是酸,则它们酸性最强的是H3PO4(填化学式,下同),最弱的是HPO42-.
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为CO2+ClO-+H2O═HClO+HCO3-,1.2mol•L-1的NaClO溶液pH=10.8(已知:lg2=0.3).
(3)求出该温度下,0.10mol•L-1的CH3COOH溶液中的c(H+)=1.4×10-3mol•L-1.