题目内容
9.某学生做葡萄糖的还原性实验,4mL 0.5mol/L的CuSO4溶液和4mL 0.5mol/L的NaOH溶液,将它们混合后,滴入1.0mL的10%的葡萄糖溶液,加热煮沸,结果没有看到红色沉淀生成.这是因为( )| A. | 葡萄糖浓度太大 | B. | 加热时间不够 | ||
| C. | CuSO4溶液的量不够 | D. | NaOH溶液的量不够 |
分析 新制Cu(OH)2溶液的反应式为:CuSO4+2NaOH$\frac{\underline{\;加热\;}}{\;}$Cu(OH)2↓+Na2SO4,该反应在氢氧化钠稍过量的情况下才能产生Cu(OH)2.
解答 解:A.只要有醛基即可反应,与葡萄糖浓度无关,故A错误;
B.葡萄糖和新制Cu(OH)2只要加热就可反应,故B错误;
C.n(NaOH)=0.5mol/L×0.004L=0.002mol,由反应CuSO4+2NaOH$\frac{\underline{\;加热\;}}{\;}$Cu(OH)2↓+Na2SO4可知:n(NaOH)=2n(CuSO4),n(CuSO4)=0.001mol,应该加CuSO42mL,实际加了4mL,故C错误;
D.n(CuSO4)=0.5mol/L×0.004L═0.002mol,根据反应CuSO4+2NaOH$\frac{\underline{\;加热\;}}{\;}$Cu(OH)2↓+Na2SO4可知:n(NaOH)=2n(CuSO4)=0.004mol=0.5mol/L×V,解得V=8mL,应该加0.5mol/L NaOH溶液8mL,实际只加了4mL,所以NaOH溶液的量不够,故D正确.
故选:D.
点评 本题主要考查了用新制Cu(OH)2检验醛基的反应,以及制取Cu(OH)2溶液的反应.本题相对比较基础.

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案
相关题目
13.下列实验操作中正确的是( )
| A. | 分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出 | |
| B. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| C. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
14.下列说法正确的是( )
| A. | 1L水中溶解了58.5g NaCl,该溶液的物质的量浓度为1mol/L | |
| B. | V L Fe2(SO4)3溶液中含a g SO42-,取此溶液0.5VL用水稀释成2V L,则稀释后溶液的c(Fe3+)为$\frac{a}{4V}$ mol/L | |
| C. | 实验室需240mL2mol/L的CuSO4溶液,配置时应称125.0gCuSO4•5H2O | |
| D. | 10mL质量分数为98%的H2SO4,用水稀释至100mL,质量分数变为9.8% |
17.与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示).下表是某温度下几种常见弱酸的电离平衡常数:
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3-、H3PO4、H2PO4-、HPO42-都看作是酸,则它们酸性最强的是H3PO4(填化学式,下同),最弱的是HPO42-.
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为CO2+ClO-+H2O═HClO+HCO3-,1.2mol•L-1的NaClO溶液pH=10.8(已知:lg2=0.3).
(3)求出该温度下,0.10mol•L-1的CH3COOH溶液中的c(H+)=1.4×10-3mol•L-1.
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| HClO | CHl0?ClO-+H+ | 3.0×10-8 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.4×10-7 K2=5.61×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++HPO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
(1)若把CH3COOH、HClO、H2CO3、HCO3-、H3PO4、H2PO4-、HPO42-都看作是酸,则它们酸性最强的是H3PO4(填化学式,下同),最弱的是HPO42-.
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为CO2+ClO-+H2O═HClO+HCO3-,1.2mol•L-1的NaClO溶液pH=10.8(已知:lg2=0.3).
(3)求出该温度下,0.10mol•L-1的CH3COOH溶液中的c(H+)=1.4×10-3mol•L-1.
4.胶体分散系在日常生活中很常见.下列说法不正确的是( )
| A. | 将饱和的FeCl3溶液滴入沸水中形成Fe(OH)3胶体 | |
| B. | CuSO4溶液可观察到丁达尔现象 | |
| C. | Fe(OH)3胶体可观察到丁达尔现象 | |
| D. | 胶体分散系中所有粒子的直径都不在1~100 nm之间 |
14.如图实验装置、试剂选用或操作正确的是( )
| A. |  用水吸收氨气 | B. |  除去CO2中含有的少量HCl | ||
| C. |  稀释浓硫酸 | D. |  海带灼烧成灰 |
1.下列对合成材料的认识不正确的是( )
| A. | 苯酚和甲醛在一定条件下可合成酚醛树脂 | |
| B. | 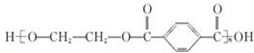 的单体是 HOCH2CH2OH 与 的单体是 HOCH2CH2OH 与  | |
| C. | 聚苯乙烯是由苯乙烯加聚生成的纯净物 | |
| D. | 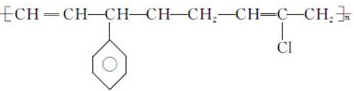 的单体有3种 的单体有3种 |