题目内容
1.设NA表示阿伏加德罗常数值.下列说法正确的是( )| A. | 常温下,Na2O2与N2和CO2组成的混合气体反应生成0.5mol O2时,转移电子数是2NA | |
| B. | 标准状况下,11.2 L的甲醇所含的氢原子数等于2NA | |
| C. | 电解饱和食盐水,阳极产生22.4 L气体时,电路中通过的电子数目为2NA | |
| D. | 1L 1 mol/L CuCl2溶液中含有的氯离子数为2NA |
分析 A、用过氧化钠制取氧气时,氧元素的价态由-1价变为0价;
B、标况下甲醇为液体;
C、阳极生成的气体所处的状态不明确;
D、求出氯化铜的物质的量,然后根据氯化铜中含2个氯离子来分析.
解答 解:A、用过氧化钠制取氧气时,氧元素的价态由-1价变为0价,故生成0.5mol氧气时转移NA个电子,故A错误;
B、标况下甲醇为液体,不能根据气体摩尔体积来计算其物质的量,故B错误;
C、阳极生成的气体所处的状态不明确,故其物质的量无法计算,则转移的电子数无法计算,故C错误;
D、溶液中氯化铜的物质的量n=CV=1mol/L×1L=1mol,而氯化铜中含2个氯离子,故1mol氯化铜中含2NA个氯离子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
12.某温度下,一反应平衡常数K=$\frac{{c}_{CO}×{c}_{{H}_{2}O}}{{c}_{C{O}_{2}}×{c}_{{H}_{2}}}$.恒容时到达平衡后,升高温度,H2浓度减小.下列说法正确的是( )
| A. | 升温,逆反应速率减小 | B. | 加压,H2浓度减小 | ||
| C. | 增加H2,K减小 | D. | 该反应的正反应是吸热反应 |
16.茉莉酮可用作食用香精,其结构如图所示,下列关于其叙述正确的是( )
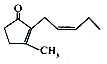

| A. | 茉莉酮易溶于水 | |
| B. | 茉莉酮中含有两种官能团 | |
| C. | 茉莉酮可与溴水、酸性KMnO4溶液发生加成反应,现象均为褪色 | |
| D. | 茉莉酮与二氢茉莉酮 互为同分异构体 互为同分异构体 |
6.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 验证Fe(NO3)2是否变质 | 将Fe(NO3)2溶于稀硫酸中,再滴加KSCN溶液,观察是否变化 |
| B | 制备Fe(OH)3胶体 | 向沸水中滴加饱和FeCl3溶液,加热并搅拌 |
| C | 证明氧化性H2O2比Fe3+强 | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
| D | 验证Ksp(AgI)<Ksp(AgCl) | 向AgCl的悬浊液中滴加KI溶液,出现黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
13.36.96L(标准状况)的H2、D2、O2的混合气体点燃正好完全反应,生成20g的H2O、D2O、HDO组成的水,原混合物中的O2的质量是( )
| A. | 16g | B. | 17.6g | C. | 17.8g | D. | 18g |