题目内容
9.现有一溶液,取0.5L这种溶液作为样品,经测定该样品中含有4.8g的Mg2+ 则:(1)该泉水中Mg2+的物质的量的浓度是多少?
(2)为使该泉水样品所含的Mg2+全部沉淀,应加入1mol/L NaOH溶液的体积是多少?
分析 结合m=nM、n=cV及Mg2++2OH-=Mg(OH)2↓计算.
解答 解:(1)0.5L这种泉水作为样品,经测定该样品中含有0.48g的Mg2+,n=$\frac{4.8g}{24g/mol}$=0.2mol,Mg2+的物质的量的浓度是$\frac{0.2mol}{0.5L}$=0.4mol/L.
答:Mg2+的物质的量的浓度是0.4mol/L;
(2)由Mg2++2OH-=Mg(OH)2↓可知,使该泉水样品所含的Mg2+全部沉淀,应加入1mol/L NaOH溶液的体积是$\frac{0.2mol×2}{1mol/L}$=0.4L.
答:加入1mol/L NaOH溶液的体积是0.4L.
点评 本题考查化学反应的计算,为高频考点,把握浓度及化学反应方程式的计算为解答的关键,侧重分析与计算能力的考查,注意基本计算公式的应用,题目难度不大.

练习册系列答案
相关题目
20.下列实验中关于物质检验的结论错误的是( )
| 实验步骤 | 现象 | 结论 | |
| A | 取待测液,滴加酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 待测液中可能含Fe2+ |
| B | 将待测气体通入品红溶液中,稍后加热溶液 | 开始品红溶液褪色,加热后又变为红色 | 待测气体中肯定含SO2 |
| C | 取待测液,滴加硝酸酸化的 BaCl2溶液 | 生成白色沉淀 | 待测液中可能含Ag+ |
| D | 将湿润的KI淀粉试纸较长时间置于待测气体中 | 取出后没有观察到试纸变色 | 待测气体中肯定不含Cl2 |
| A. | A | B. | B | C. | C | D. | D |
1.设NA表示阿伏加德罗常数值.下列说法正确的是( )
| A. | 常温下,Na2O2与N2和CO2组成的混合气体反应生成0.5mol O2时,转移电子数是2NA | |
| B. | 标准状况下,11.2 L的甲醇所含的氢原子数等于2NA | |
| C. | 电解饱和食盐水,阳极产生22.4 L气体时,电路中通过的电子数目为2NA | |
| D. | 1L 1 mol/L CuCl2溶液中含有的氯离子数为2NA |
18.下列各组物质在水中混合后,有白色沉淀且有刺激性气味的气体产生的是( )
| A. | NaHS、AlCl3 | B. | Al2(SO4)3、NaHCO3 | C. | Na2SO4、BaCO3 | D. | Na2CO3、CuSO4 |
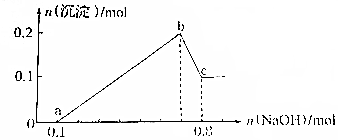 某溶液中可能含有H+、Mg2+、Al3+、Fe3+、Na+等阳离子中的一种或几种,当向该溶液中加入NaOH溶液时,产生沉淀的物质的量与所加NaOH物质的量之间的关系如图所示
某溶液中可能含有H+、Mg2+、Al3+、Fe3+、Na+等阳离子中的一种或几种,当向该溶液中加入NaOH溶液时,产生沉淀的物质的量与所加NaOH物质的量之间的关系如图所示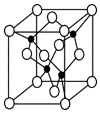 X、Y、Z、U、W 是原子序数依次增大的前四周期元素.其中 Y 的原子核外有 7 种运动状态不同的 电子;X、Z 中未成对电子数均为 2;U 是第三周期元素形成的简单离子中半径最小的元素;W 的内层电 子全充满,最外层只有 1 个电子.请回答下列问题:
X、Y、Z、U、W 是原子序数依次增大的前四周期元素.其中 Y 的原子核外有 7 种运动状态不同的 电子;X、Z 中未成对电子数均为 2;U 是第三周期元素形成的简单离子中半径最小的元素;W 的内层电 子全充满,最外层只有 1 个电子.请回答下列问题: .
. .
.