题目内容
11.1g H2的热值为142.9KJ热量,下列反应的热化学方程式正确的是( )| A. | H2+O2═2H2O△H=-571.6KJ/mol | |
| B. | H2 (g)+$\frac{1}{2}$O2(g)═H2O (l)△H=-142.9KJ/mol | |
| C. | H2 (g)+$\frac{1}{2}$O2(g)═H2O (l)△H=-285.8KJ/mol | |
| D. | 2H2(g)+O2(g)═2H2O (g)△H=-571.6KJ/mol |
分析 书写热化学方程式除了要遵循书写化学方程式的要求外,还应注意以下几方面:
(1)必须注明各反应物、生成物的状态(s、l、g、aq),不标“↑”和“↓”符号;
(2)反应热△H与测定条件(温度、压强)有关,若不说明则指常温(25℃)、常压(101kPa)下;
(3)△H只能写在标有反应物或生成物状态的化学方程式的右边,并用“;”隔开.若为吸热反应,△H为“+”;若为放热反应,△H为“-”.△H的单位一般为kJ/mol;
(4)热化学方程式中的化学计量数仅表示该物质的物质的量,不表示物质的分子或原子数,因此可以是整数或分数;
(5)△H与热化学方程式中化学式前面的化学计量数成正比.当反应逆向进行时,其反应热与正反应的反应热数值相等,但符号相反;
(6)书写燃烧热的热化学方程式时,应以燃烧1mol物质为标准来配平其他物质化学式前面的化学计量数,据此进行解答.
解答 解:1g氢气燃烧生成液态水,放出142.9kJ热量,所以1mol氢气燃烧生成液态水,放出的热量为142.9kJ×2=285.8kJ,
A.热化学方程式必须注明各物质的状态,故A错误;
B.焓变数值错误,1mol氢气燃烧生成液态水时放出的热量为285.8kJ,△H=-285.8kJ/mol,故B错误;
C.1mol氢气燃烧生成液态水,放出的热量为142.9kJ×2=285.8kJ,该反应的热化学方程式为:H2 (g)+$\frac{1}{2}$O2(g)═H2O (l)△H=-285.8KJ/mol,故C正确;
D.生成水的状态错误,应该为液态水,故D错误;
故选C.
点评 本题考查了热化学方程式的书写方法,题目难度不大,明确热化学方程式的书写原则为解答关键,注意反应热化学方程式需要标注物质聚集状态,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | R和N元素的原子含有相同数目的未成对电子 | |
| B. | RO3-中R的化合价与NO3-中的N的化合价不相等 | |
| C. | RO3-和NO3-只能被还原,不能被氧化 | |
| D. | R原子的电子层数比N的电子层数多1 |
| A. | PCl5 | B. | BF3 | C. | CCl4 | D. | NH3 |
| A. | 上述反应中生成的N2是火箭燃料燃烧后的氧化产物 | |
| B. | 推动火箭飞行的强大动力源于该反应瞬间产生的大量高温气体 | |
| C. | 火箭发射时看到的红棕色气体是火箭起飞后,保险活动门自动开启,排出部分高压氧化剂在空气中氧化的结果 | |
| D. | 从能量变化上看,上述反应是热能转化为动能 |
| A. | 5.4g | B. | 6.3g | C. | 7.2g | D. | 9.0g |
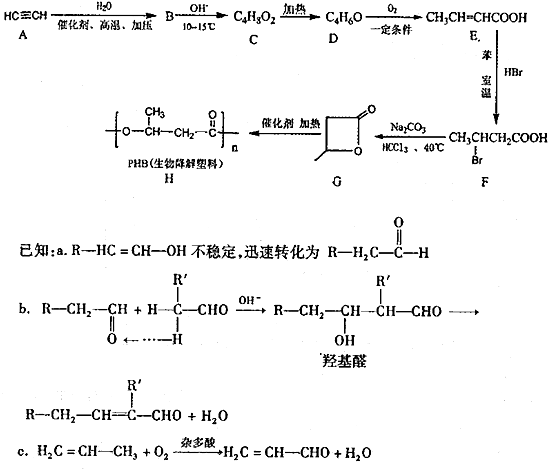
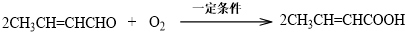 .
.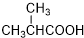 .
.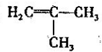 为起始原料(其他原料任选),制备
为起始原料(其他原料任选),制备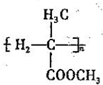 的合成路线:
的合成路线: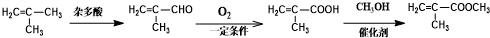
 .
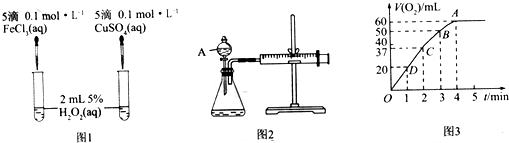
.
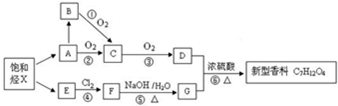
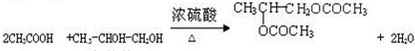 .
.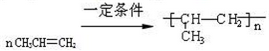 .
.