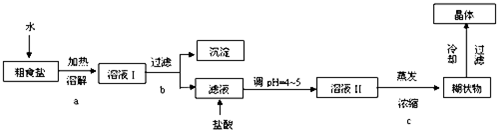
题目内容
16.H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了图1、图2两种实验装置.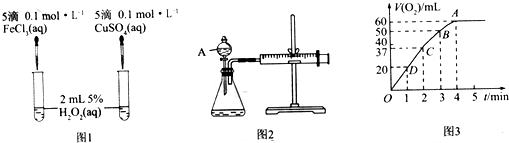
(1)若利用图1实验,可通过观察产生气泡的快慢定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是消除阴离子不同对实验的干扰,写出H2O2在二氧化锰催化作用下发生反应的化学方程式:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.若利用图2实验可进行定理分析,图中仪器A的名称为分液漏斗,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是产生40mL气体所需的时间.
(2)将0.1mol MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示,解释反应速率变化的原因:随着反应的进行,浓度减小,反应速率减慢,H2O2初始物质的量浓度为0.11 mol/L(保留两位有效数字).
(3)为了加深同学们对影响反应速率因素的认识,老师让同学完成如下实验:
在上述实验装置的锥形瓶内加入6.5g锌粒,通过分液漏斗加入40mL 2.5mol•L-1的硫酸,10s时收集到产生的H2的体积为44.8mL(标准状况),用硫酸表示10s内该反应的速率为0.005mol•L-1•s-1(假设反应前后溶液的体积不变).
分析 (1)比较金属阳离子的催化效果要排斥阴离子的干扰;A仪器名称是分液漏斗,检验装置气密性的方法是:关闭分液漏斗的活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位;该反应是通过反应速率分析的,所以根据v=$\frac{△c}{△t}$分析;
(2)随着反应的进行,溶液的浓度逐渐降低,反应速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2,根据2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑进行计算;
(3)根据关系式Zn~H2SO4~H2计算10s时硫酸消耗的物质的量,再根据v=$\frac{△c}{△t}$进行计算.
解答 解:(1)氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用,硫酸钠和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰,在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,A仪器名称是分液漏斗,检验装置气密性的方法是:关闭分液漏斗的活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位,如果不恢复原位,则证明气密性良好,否则不好;根据v=$\frac{△c}{△t}$知,还需要测定产生40mL气体所需的时间,
故答案为:消除阴离子不同对实验的干扰;2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑;分液漏斗;产生40mL气体所需的时间;
(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2,H2O2的分解反应为2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,则n(H2O2)=$\frac{0.06L}{22.4L/mol}$×2≈0.00536 mol,c(H2O2)=$\frac{0.00536mol}{0.05L}$≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn~H2SO4~H2
65g 1mol 22.4L
0.13g 0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=$\frac{0.002mol}{0.04L}$÷10s=0.005mol•L-1•s-1,
故答案为:0.005.
点评 本题考查实验方案设计,根据v=$\frac{△c}{△t}$来设计实验,通过得到气体的体积和时间的关系确定影响反应速率的因素,难度中等.

 步步高达标卷系列答案
步步高达标卷系列答案| A. | 150mL | B. | 200mL | C. | 450mL | D. | 无法计算 |
| A. | H2+O2═2H2O△H=-571.6KJ/mol | |
| B. | H2 (g)+$\frac{1}{2}$O2(g)═H2O (l)△H=-142.9KJ/mol | |
| C. | H2 (g)+$\frac{1}{2}$O2(g)═H2O (l)△H=-285.8KJ/mol | |
| D. | 2H2(g)+O2(g)═2H2O (g)△H=-571.6KJ/mol |
| A. | N2、H2O、NO | B. | NH3、CO2、NO | C. | NH3、O2、NO | D. | H2O、NO2、CO2 |
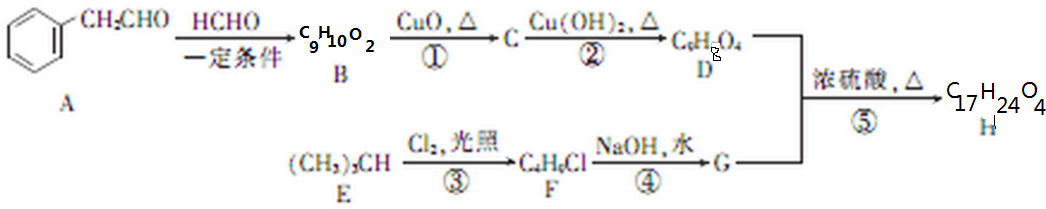
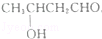
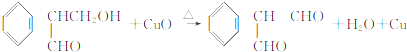
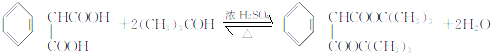
 (不考虑立体异构)?
(不考虑立体异构)?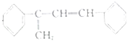 的合成路线.
的合成路线.